题目内容
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是:( )
物质 | X | Y | Z |
初始浓度/ | 0.1 | 0.2 | 0 |
平衡浓度/ | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增压使平衡向生成Z的方向移动,平衡常数增大
【答案】D
【解析】
根据表格中的数据可知反应物为X和Y,Z为生成物,X、Y、Z的浓度变化量分别为0.05molL-1,0.15molL-1,0.10molL-1,变化量之比等于计量数之比,因此方程式为X(g)+3Y(g)![]() 2Z(g),由三段法有:
2Z(g),由三段法有:
X(g) + 3Y(g) ![]() 2Z(g)
2Z(g)
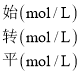
![]()
![]()
![]()
据此进行分析判断。
A. X的转化率为![]() ×100%=50%,A项正确;
×100%=50%,A项正确;
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为
2Z,其平衡常数为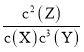 =
=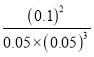 =1600,B项正确;
=1600,B项正确;
C. 平衡常数只与温度有关,因此改变温度可以改变此反应的平衡常数,C项正确;
D. 增压使平衡向生成Z的方向移动,但平衡常数只与温度有关,改变压强平衡常数不变,D项错误;
答案选D。

【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2 =5.6×10-6 |
回答下列问题:
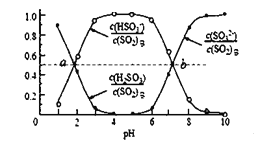
(1)浓度均为0.1 molL-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_____________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为________________。Na2HPO3是_____________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 molL-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是______(填字母)。
A.c(H+) B.  C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2 mol L-1的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_______________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是____________________________。