题目内容
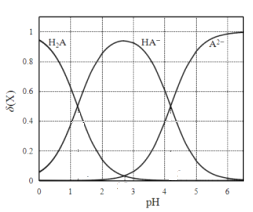
【题目】常温下,Ka(HCOOH) =1.77×10—4,Ka(CH3COOH) =1.75×10—5,下列说法正确的是
A. pH均为3的HCOOH和盐酸等体积混合后,pH变小
B. 0.2 molL—1 CH3COONa 与 0.1 molL﹣1盐酸等体积混合后的溶液中(pH<7):c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+)
C. 0.2 molL—1 HCOOH 与 0.1 molL—1 NaOH 等体积混合后的溶液中:c(HCOO—) +c(HCOOH) =0.2 molL—1
D. 中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量不同
【答案】B
【解析】A、根据Ka(HCOOH) =1.77×10—4可知,HCOOH为弱酸,pH均为3的HCOOH和盐酸等体积混合后,HCOOH的电离受抑制,电离程度减小,氢离子浓度减小,pH变大,选项A错误;B、混合后为等浓度的CH3COOH和CH3COONa的混合液,由其显酸性可知以CH3COOH的电离为主,导致c(CH3COOH)<c(CH3COO-),c(Na+)= c(Cl—)<c(HCOO-),故c(CH3COO—)>c(Cl—)>c(CH3COOH)>c(H+),选项B正确;C、等体积混合后,根据物料守恒有:c(HCOO—) +c(HCOOH) =![]() = 0.1molL—1,选项C错误;D、根据反应HCOOH+NaOH=HCOONa+H2O、CH3COOH+NaOH=CH3COONa+H2O可知,中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量相同,选项D错误。答案选B。
= 0.1molL—1,选项C错误;D、根据反应HCOOH+NaOH=HCOONa+H2O、CH3COOH+NaOH=CH3COONa+H2O可知,中和浓度和体积均相同的HCOOH和CH3COOH,所用NaOH的物质的量相同,选项D错误。答案选B。

【题目】研究化学反应速率和化学反应限度具有重要意义。回答下列问题:
(Ⅰ)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL-1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL-1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL-1FeCl3溶液 |
(1)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进措施是_________________________________________。
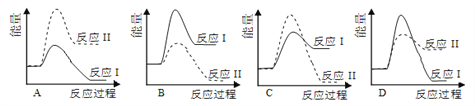
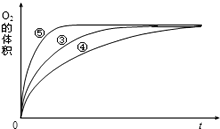
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析图能够得出的实验结论是__________________________________。
(Ⅱ)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈CH3CN等。
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①CH2=CHCH3(g)+NH3(g)+ 3/2 O2(g)→ CH2=CHCN(g)+3H2O(g) △H=-515 kJ/mol
②CH2=CHCH3(g)+ O2(g)→C3H4O(g)+H2O(g) △H=-353 kJ/mol
有利于提高丙烯腈平衡产率的反应条件是_______________;提高丙烯腈反应选择性的关键因素是__________。
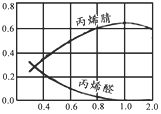
(2)丙烯腈和丙烯醛的产率与n(NH3)/n (丙烯)的关系如图所示。由图可知,最佳n(NH3)/n (丙烯)约为________,理由是________________。氨、丙烯、空气的进料理论体积比约为__________。