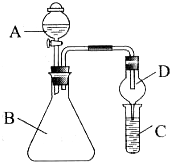
题目内容
19.下列实验装置设计正确的是( )| A. | 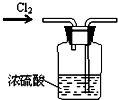 干燥氯气 | B. |  稀释浓硫酸 | ||
| C. |  实验室制氨气 | D. | 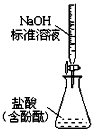 测定盐酸浓度 |
分析 A.氯气进出方向错误;
B.稀释浓硫酸时,应防止酸液飞溅;
C.氯化铵和氢氧化钙在加热条件下可生成氨气,氨气密度比空气小,可用向下排空法收集;
D.氢氧化钠溶液不能放在酸式滴定管中.
解答 解:A.干燥氯气时,氯气应从长管进,短管出,故A错误;
B.稀释浓硫酸时,应将浓硫酸沿烧杯内壁缓缓倒入烧杯中,并用玻璃棒不断搅拌,防止酸液飞溅,故B错误;
C.氯化铵和氢氧化钙在加热条件下可生成氨气,氨气密度比空气小,可用向下排空法收集,可用于制备并收集氨气,故C正确;
D.氢氧化钠溶液可腐蚀玻璃,不能放在酸式滴定管中,故D错误.
故选C.
点评 本题考查较为综合,涉及气体的制备、收集,物质的分离等知识,为高考常见题型,侧重学生的分析能力和实验能力的考查,注意把握实验的可行性的评价,难度不大.

练习册系列答案
相关题目
11.①1-丙醇 ②1,3-丙二醇 ③丙烷 ④乙醇 ⑤丙三醇等物质的沸点排列顺序正确的是( )
| A. | ⑤>②>①>③>④ | B. | ⑤>④>③>②>① | C. | ⑤>②>①>④>③ | D. | ②>①>⑤>④>③ |
12.写出下列原子的核外电子排布式:
(1)17Cl1s22s22p63s23p5;
(2)24Cr[Ar]3d54s1;
(3)34Se[Ar]3d104s24p4;
(4)29Cu[Ar]3d104s1.
(1)17Cl1s22s22p63s23p5;
(2)24Cr[Ar]3d54s1;
(3)34Se[Ar]3d104s24p4;
(4)29Cu[Ar]3d104s1.
4.为了确定某样品是否被氧化,所选试剂(括号内物质)不正确的是( )
| A. | FeCl2(NH4SCN溶液) | B. | KI(淀粉溶液) | ||
| C. | 白磷(紫色石蕊试液) | D. | Na2SO3( BaCl2 溶液) |
11.现有一由Na2SO4、Na2SO3、Na2S组成的混和物,经测定硫的质量分数为2 5.6%,则此混合物中氧元素的质量分数应为( )
| A. | 37.6% | B. | 36.8% | C. | 25.6% | D. | 51.2% |
8.下列说法中正确的是( )
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 由不同原子所形成的纯净物一定是化合物 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 离子化合物一定能导电 |
9.用如图所示装置进行实验,装置正确且设计合理的是( )
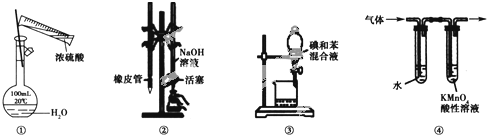

| A. | 图①所示装置进行浓硫酸稀释配制稀硫酸的实验 | |
| B. | 图②所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验 | |
| C. | 图③所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出 | |
| D. | 图④所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯 |