题目内容
12.写出下列原子的核外电子排布式:(1)17Cl1s22s22p63s23p5;
(2)24Cr[Ar]3d54s1;
(3)34Se[Ar]3d104s24p4;
(4)29Cu[Ar]3d104s1.
分析 原子的左下角为质子数,核外电子数=质子数,根据能量最低原则、泡利不相容原理和洪特规则综合考虑,写出核外电子排布式.
解答 解:(1)Cl所含质子数为17,原子核外电子数为17,根据能量最低原则、泡利不相容原理和洪特规则核外电子排布式为1s22s22p63s23p5,
故答案为:1s22s22p63s23p5;
(2)Cr所含质子数为24,原子核外电子数为24,3d能级上的原子轨道处于半满时,能量较低,因此核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;
(3)Se所含质子数为34,原子核外电子数为34,根据能量最低原则、泡利不相容原理和洪特规则写出为[Ar]3d104s24p4,
故答案为:[Ar]3d104s24p4;
(4)Cu所含质子数为29,原子核外电子数为29,3d能级上的原子轨道处于全满时,能量较低,因此核外电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d104s1.
点评 本题考查了原子核外电子排布式的书写,Cr、Cu的电子排布书写为解答的易错点,注意半满为稳定状态,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
2.在标准状况下,mgA气体与ngB气体分子数相等,下列说法不正确的是( )
| A. | 标准状况下,同体积的气体A、B质量比m:n | |
| B. | 25℃时,1Kg气体A与1Kg气体B的分子数之比为n:m | |
| C. | 同温同压下,气体A与气体B的密度之比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
20.已知 和
和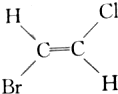 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
 和
和 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 食品添加剂对人体的健康均无害,所以不用严格控制用量 | |
| B. | 棉、麻、丝、毛的主要成分都是纤维素 | |
| C. | 光纤的主要成分是二氧化硅 | |
| D. | 农业施肥所用的碳铵和尿素均属于无机物 |
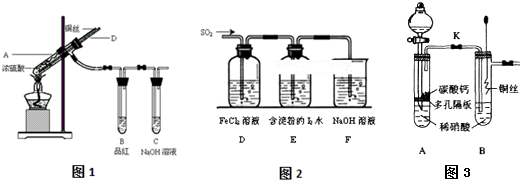
19.下列实验装置设计正确的是( )
| A. | 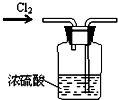 干燥氯气 | B. |  稀释浓硫酸 | ||
| C. |  实验室制氨气 | D. | 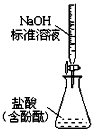 测定盐酸浓度 |
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.