题目内容
7.硼、镁及其化合物在工农业生产中应用广泛.已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程如下.
回答下列有关问题.
(1)硼砂中B的化合价为+3,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为B4O72-+2H++5H2O=4H3BO3.X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO,该反应中的氧化剂是B2O3(填化学式).
(2)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,这一变化的化学方程式为H3BO3+H2O?[B(OH)4]-+H+.皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为H3BO3+OH-=[B(OH)4]-.
(3)MgCl2•7H2O需要在HCl氛围中加热制MgCl2,其目的是防止MgCl2水解生成Mg(OH)2.
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼.现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol/LNa2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL.盛装Na2S2O3溶液的仪器应为碱式(填“酸式”或“碱式”)滴定管.该粗硼样品的纯度为97.2%(提示:I2+2S2O32-=2I-+S4O62-).
分析 硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程中硼镁矿加入氢氧化钠浓溶液过滤得到氯化镁,加入浓盐酸溶解通过蒸发浓缩得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,电解得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,溶于热水后,用H2SO4调pH2~3制取H3BO3,加热得到B2O3;
(1)硼砂的化学式为Na2B4O7•10H2O,依据元素化合价标注计算硼元素化合价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ;X为H3BO3晶体加热脱水的产物得到B2O3,镁和得到B2O3反应生成氧化镁和硼,反应中元素化合价降低的做氧化剂;
(2)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,据此书写离子方程式,硼酸与氢氧化钠反应生成四羟基硼酸根;
(3)氯化镁在水溶液中水解生成氢氧化镁;
(4)H2S2O3为弱酸,Na2S2O3溶液显碱性,据此选择滴定管;根据关系式B~BI3~$\frac{3}{2}$I2~3S2O32-及滴定数据计算出粗硼中硼的含量.
解答 解:(1)硼砂的化学式为Na2B4O7•10H2O,钠元素化合价为+1价,氧元素化合价-2价,依据化合价代数和计算得到硼元素化合价为+3价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3,X为H3BO3晶体加热脱水的产物是B2O3,镁和得到B2O3反应生成氧化镁和硼,反应的化学方程式为:3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO,反应中元素化合价降低的做氧化剂,硼元素化合价+3价变化为0价,则B2O3做氧化剂;
故答案为:+3;B4O72-+2H++5H2O=4H3BO3;3Mg+B2O3$\frac{\underline{\;高温\;}}{\;}$2B+3MgO;B2O3;
(2)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,据此书写离子方程式为:H3BO3+H2O?[B(OH)4]-+H+,硼酸是一元弱酸与氢氧化钠反应生成四羟基硼酸根,反应的离子方程式为:H3BO3+OH-=[B(OH)4]-;
故答案为:H3BO3+H2O?[B(OH)4]-+H+;H3BO3+OH-=[B(OH)4]-;
(3)MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁,
故答案为:防止MgCl2水解生成Mg(OH)2;
(4)H2S2O3为弱酸,Na2S2O3溶液显碱性,据此选择滴定管应为简式滴定管;
硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,I2+2S2O32-=2I-+S4O62-,
根据关系式:B~BI3~$\frac{3}{2}$I2~3S2O32-,
n(B)=$\frac{1}{3}$n(S2O32-)=0.0018mol,
硼的质量为:10.81g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:$\frac{0.01944g}{0.0200g}$×100%=97.2%,
故答案为:碱式;97.2%.
点评 本题考查了盐类的水解、原电池原理和电解池原理的分析,沉淀溶解平衡的计算应用,题目难度稍大,计算是难点,计算时要充分利用题目所给数量关系和表中数据,根据质量关系和质量分数的概念快速解题.

| A. | 发生化学反应时,失去电子越多的金属原子,其还原能力越强 | |
| B. | 目前已发现118种元素,即已发现118种原子 | |
| C. | 核外电子总数相同的粒子,必定是同种元素的原子 | |
| D. | 同一元素的各种同位素的化学性质基本相同 |
 和
和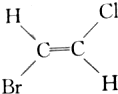 互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )
互为同分异构体(顺反异构),则化学式为C3H5Cl的链状化合物的同分异构体共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 食品添加剂对人体的健康均无害,所以不用严格控制用量 | |
| B. | 棉、麻、丝、毛的主要成分都是纤维素 | |
| C. | 光纤的主要成分是二氧化硅 | |
| D. | 农业施肥所用的碳铵和尿素均属于无机物 |
| A. | 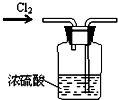 干燥氯气 | B. |  稀释浓硫酸 | ||
| C. |  实验室制氨气 | D. |  测定盐酸浓度 |
| A. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+ | |
| B. | 肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- | |
| C. | 肯定有K+、Al3+、MnO4-,可能有HCO3- | |
| D. | 肯定有Al3+、Mg2+、Cl-,可能有K+ |
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |