题目内容
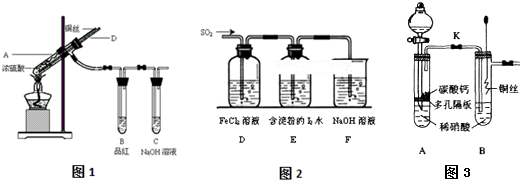
14.利用如图装置可以验证非金属性的变化规律.
(1)仪器A的名称为分液漏斗
(2)要证明非金属性:Cl>C>Si,则A中加稀HCl,B中加入CaCO3,
C中加入NaSiO3溶液,观察到C中溶液的现象是有白色沉淀产生.
(3)实验室现有药品Na2S、KMnO4、MnO2、浓盐酸,设计实验选择合适药品证明氯的非金属性大于硫,装置C中实验现象为有黄色沉淀生成,其离子方程式为S2-+Cl2═S↓+2Cl-.
分析 (1)仪器A的名称为分液漏斗;
(2)盐酸与碳酸钙反应生成二氧化碳,二氧化碳和硅酸钠反应生成难溶性的硅酸,应用强酸制弱酸的原理设计实验;
(3)根据氯气将硫离子置换成硫单质,可知氯的非金属性大于硫.
解答 解:(1)仪器A的名称为分液漏斗,故答案为:分液漏斗;
(2)若要证明非金属性:Cl>C>Si,则在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,二氧化碳和硅酸钠反应生成白色沉淀硅酸,
故答案为:稀HCl; CaCO3; NaSiO3溶液;有白色沉淀产生;
(3)因为强氧化性制弱氧化性,要证明氯的非金属性大于硫,则向硫化钠溶液中通入氯气,如果有黄色的硫单质生成,即可证明,离子方程式为:S2-+Cl2═S↓+2 Cl-,故答案为:S2-+Cl2═S↓+2 Cl-.
点评 本题考查了实验方案设计,涉及非金属性强弱的探究,明确物质的性质是解本题关键,同时考查学生灵活运用知识解答问题的能力,题目难度不大.

练习册系列答案
相关题目
6.据报道,${\;}_{67}^{166}$Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
9.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如图1:

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
(1)从滤渣1中分离出Al2O3的部分流程如下所示,括号中表示加入过量的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
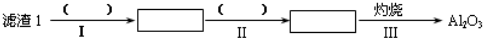
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②不同温度下Li2CO3和Li2SO4的溶解度如下表:
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
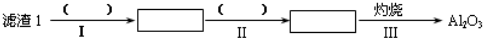
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(3)工业上用电解法将Li2CO3粗品制成高纯Li2CO3,其中向电解后所得的纯LiOH溶液中加入过量NH4HCO3溶液可生成Li2CO3,反应的化学方程式是2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.
19.下列实验装置设计正确的是( )
| A. | 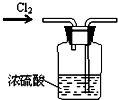 干燥氯气 | B. |  稀释浓硫酸 | ||
| C. |  实验室制氨气 | D. | 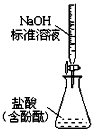 测定盐酸浓度 |
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
3.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn+2 OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-,总反应式为Ag2O+Zn=ZnO+2Ag,根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
4.下列推论正确的( )
| A. | SiH4的沸点高于CH4,可推测PH3的沸点也高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | PCl3 为三角锥形,可推测NF3也为三角锥形结构 | |
| D. | C2H6的碳链是直线型的,可推测C3H8的碳链也是直线型的 |