题目内容
5.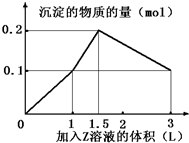 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 氯化铝、氯化铁、氢氧化钠 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 偏铝酸钠、氯化钡、硫酸 | D. | 偏铝酸钠、氢氧化钡、硫酸 |
分析 根据图象分析,若Z为氢氧化钠溶液,Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,溶液中沉淀量达到最大时,生成氢氧化铝沉淀、氢氧化铁沉淀、氢氧化镁沉淀时沉淀物质的量和消耗的碱的物质的量不符合,X不能是铝盐;所以Z是硫酸溶液,据此进行解答.
解答 解:A.若X、Y、Z分别为氯化铝、氯化铁、氢氧化钠,开始滴入氢氧化钠时,Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,n(Al3+):n(OH-)=1:3,n(Fe3+):n(OH-)=1:3,继续滴加Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,不符合图象的数值变化,故A错误;
B.若X、Y、Z分别为氯化铝、氯化镁、氢氧化钠,开始滴入氢氧化钠时,Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,n(Mg2+):n(OH-)=1:2,n(Al3+):n(OH-)=1:3,继续滴加Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,不符合图象的数值变化,故B错误;
C.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2++SO42-=BaSO4↓,H++AlO2-+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故C错误;
D.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时OH-+H+=H2O,Ba2++SO42-=BaSO4↓,
H++AlO2-+H2O=Al(OH)3↓,
图中第一段直线:氢氧化钡的OH-和硫酸里的H+1:1中和,同时Ba2+和SO42-1:1反应生成硫酸钡沉淀,
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
图中第二段直线氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应H++AlO2-+H2O=Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1:2;
图中第三段直线:硫酸进一步过量,开始消耗沉淀,Al(OH)3+3H+=Al3++3H2O硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4,以上三段符合图象的数值变化,故D正确;
故选D.
点评 本题考查了铝盐、偏铝酸盐和钡盐与碱、酸反应的图象分析判断,题目难度中等,需要从图象中分析数据结合物质反应和沉淀生成判断,试题侧重考查学生的分析、理解能力及灵活应用基础知识解决实际问题的能力.

(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+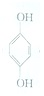 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为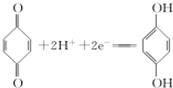 .
.(2)25℃时.将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当混合溶液中,c(NH4+)=c(Cl-)时.则溶液的pH=7.
②当混合溶液中,c(NH4+)>c(Cl-)时.则反应的情况可能为a.
a.盐酸不足.氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”、“小于”或“等于”)v逆(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:H2S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{氧化}{→}$H2SO4
(1)物质发生不完全燃烧时的反应热难以通过实验测得.已知硫化氢气体的燃烧热是586kJ/mol,固体硫单质的燃烧热是297 kJ•mol-1.写出硫化氢气体不完全燃烧生成固体硫单质的热化学方程式H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol.
(2)工业生产中硫化氢尾气可用NaOH溶液吸收.
①吸收尾气后得到的Na2S溶液显碱性(填“酸”、“碱”、“中”);
②下列与H2S、NaHS和Na2S相关的离子方程式正确的是(填字母序号)AC.
A.H2S+OH-=HS-+H2O
B.HS-+H2O=H2S+OH-
C.HS-+H2O?S2-+H3O+
D.S2-+H2O?H2S+2OH-
(3)在一定温度下,某容器中发生2H2S(g)?2H2(g)+S2(g)的反应,测得相应时间时部分物质的浓度(mol•L-1)如下表,根据表中数据回答问题:
时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
②求该温度下反应的化学平衡常数(不必写出计算过程)K=0.0025 mol•L-1.
(4)以硫化氢为原料,使用质子固体电解质(能传导H+)构成燃料电池,硫化氢放电后生成硫蒸气(化学式S2),该燃料电池的负极反应式为2H2S-4e-=S2+4H+.
(5)硫酸是强酸,在图中画出硫酸溶液和氢氧化钠溶液反应过程的能量变化示意图.
| A. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 乙醇能使酸性高锰酸钾溶液褪色,发生的是氧化反应 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
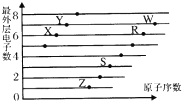 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | 该图体现出原子核外电子层呈现周期性变化 | |
| B. | 简单离子半径:W->R2->Z+>S3+ | |
| C. | R、Z形成的化合物中可能含有共价键 | |
| D. | 由酸性:HWO4>H2RO3可证明非金属性:W>R |
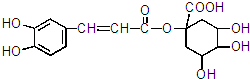 所示:
所示: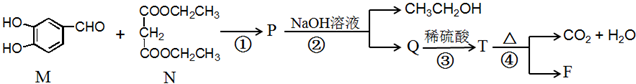

 .
.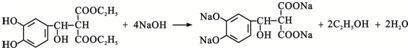 .
. .
.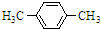 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$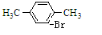 +HBr.
+HBr.