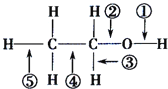
题目内容
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料,一种以含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10﹣6 |
(1)调节pH步骤中,溶液pH的调节范围是___________。
(2)滤渣1主要成分是_______________;滤渣2主要成分是_________________
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_________。
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式____________。
(5)沉镍过程中,若c(Ni2+)=2.0mol/L,欲使100mL该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10﹣5 mol/L],则需要加入Na2CO3固体的质量最少为_____g(保留小数点后1位)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸。酸浸出率随时间变化如图。酸浸的最佳温度与时间分别为____________。

【答案】5.0≤pH<6.7 SiO2、CaSO4 Al(OH)3、Fe(OH)3 2Fe2++H2O2+2H+=2Fe3++2H2O NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O 31.4 70℃、120min
【解析】
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为SiO2和CaSO4,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体,据此分析解答。
(1)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为5.0≤pH<6.7;
(2)由流程分析可知,滤渣1为SiO2和CaSO4,滤渣2为Fe(OH)3、Al(OH)3;
(3)Fe2+沉淀的pH范围与Ni2+相近,为了除去Fe2+,先加H2O2把亚铁离子氧化为Fe3+,根据电子守恒、原子守恒及电荷守恒,可得该反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)NiS用硫酸和硝酸的混合溶液酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体,则相应的气体为NO、SO2,根据电子守恒、原子守恒,可得该反应的化学方程式为:NiS+H2SO4+2HNO3=NiSO4+SO2↑+2NO↑+2H2O;
(5)已知NiCO3的Ksp=9.6×10-6,使100mL该滤液中的Ni2+沉淀完全,即c(Ni2+)≤10﹣5 mol/L,则c(CO32-)>9.6×10-6÷10﹣5=0.96mol/L,与Ni2+反应的n(CO32-)=cV=2mol/L×0.1L=0.2mol,则需要加入Na2CO3固体的总物质的量至少n(CO32-)总=0.2mol+0.96mol/L×0.1L=0.296mol,其质量最少为0.296mol ×106g/mol=31.4g;
(7)由图象可知,温度为70℃、时间为120min时,酸浸出率最高。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
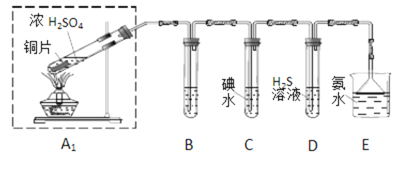
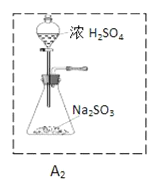
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)
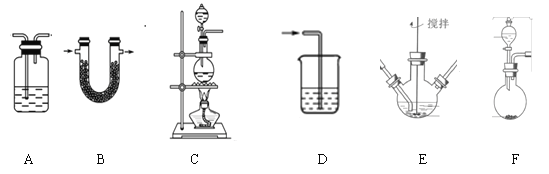
①请写出该过程中制备氯气的离子反应方程式________________(锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_________→ E →_________。(上述装置不一定全部用到,装置可以重复选用)
③装置E中反应时需进行搅拌,目的是_______________________
④E中得到紫色固体和溶液。E中生成高铁酸钾的反应为______________;反应充分进行后,E中溶液中主要的阴离子为__________________
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________