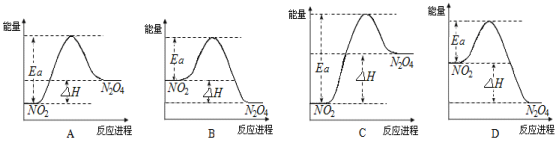
��Ŀ����
����Ŀ������������(FexNy)�ڴż�¼�����������Ź㷺��Ӧ��ǰ����ijFexNy���Ʊ���������������ͪ���Ҵ����롣
��1��Fe2+�ļ۵����Ų�ʽΪ_______��
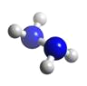
��2���������������£�N2H4���е�ԭ�ӹµ��Ӷ���֮��Ϊ_______�������ӵĿռ乹����______
��3����ͪ(![]() )������̼ԭ�ӹ�����ӻ�������_____��1 mol ��ͪ�����к�����������ĿΪ______��
)������̼ԭ�ӹ�����ӻ�������_____��1 mol ��ͪ�����к�����������ĿΪ______��
��4��C��N��O����Ԫ�صĵ縺����С�����˳��Ϊ______��
��5���Ҵ��ķе���ڱ�ͪ��������Ϊ_____��
��6��CN-��N2�ǵȵ����壬CN-�ĵ���ʽΪ______��
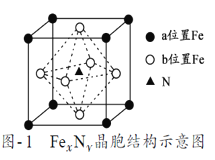
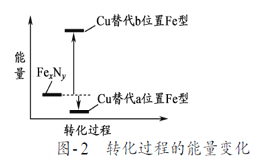
��7��ijFexNy�ľ�����ͼ1��ʾ��Cu������ȫ����þ�����aλ��Fe����bλ��Fe���γ�Cu����Ͳ���Fe(xn)CunNy��FexNyת��Ϊ����Cu����Ͳ���������仯��ͼ2��ʾ�����и��ȶ���Cu����Ͳ���Ļ�ѧʽΪ___������������Ϊa pm����þ������ܶ�Ϊ____g/cm3��
���𰸡�3d6 2:1:2 ���� sp2��sp3 9NA C<N<O �Ҵ����Ӽ������� ![]() Fe3CuN
Fe3CuN ![]()
��������
��1���������ĵ����Ų�ȷ���������ӵļ۵����Ų���
��2���������������£�N2H4����ÿ����ԭ�ӻ���һ���µ��Ӷԣ����ݼ۲���ӶԺµ��Ӷ�ȷ���ṹ��
��3����ͪ(![]() )������ÿ�����ϵ�C�γ�4���Ҽ����µ��Ӷԣ���˲�ȡsp3�ӻ����ͣ��ʻ��е�C�γ�3���Ҽ���1���м����µ��Ӷԣ���ȡsp2�ӻ����ͣ�
)������ÿ�����ϵ�C�γ�4���Ҽ����µ��Ӷԣ���˲�ȡsp3�ӻ����ͣ��ʻ��е�C�γ�3���Ҽ���1���м����µ��Ӷԣ���ȡsp2�ӻ����ͣ�
��4��ͬ����Ԫ�ش�����Ԫ�صĵ縺��������
��5�������Ӽ�����γ������ʹ�е����ߣ�ͪ����γ������
��6��CN-�Ľṹ�뵪�����ƣ�
��7����ͼ2��֪��Cu���aλ�õ�Feʱ�����ϵͣ����ȶ�����Cuλ�ڶ��㣬��̯��ȷ����ѧʽ�������������Ծ�����������ܶȣ�
��1��Fe�ļ۵����Ų�ʽΪ3d64s2����Fe2+�ļ۵����Ų�Ϊ3d6��
�𰸣�3d6
��2��������ÿ����ԭ����һ���µ��Ӷԣ���2���������е�ԭ����һ���µ��Ӷԡ��£�N2H4����ÿ����ԭ����һ���µ��Ӷԣ���2���������Ӱ����м۲���ӶԸ���=3+![]() ��5-3��1��=4�Һ���1���µ��Ӷԣ�����Nԭ�Ӳ���sp3�ӻ�����ռ乹��Ϊ�����νṹ��
��5-3��1��=4�Һ���1���µ��Ӷԣ�����Nԭ�Ӳ���sp3�ӻ�����ռ乹��Ϊ�����νṹ��
�𰸣�2:1:2 ����
��3����ͪ(![]() )������ÿ�����ϵ�C�γ�4���Ҽ����µ��Ӷԣ���˲�ȡsp3�ӻ����ͣ��ʻ��е�C�γ�3���Ҽ���1���м����µ��Ӷԣ���ȡsp2�ӻ����ͣ�
)������ÿ�����ϵ�C�γ�4���Ҽ����µ��Ӷԣ���˲�ȡsp3�ӻ����ͣ��ʻ��е�C�γ�3���Ҽ���1���м����µ��Ӷԣ���ȡsp2�ӻ����ͣ�
�𰸣� sp2��sp3 9NA
��4��ͬ����Ԫ�ش�����Ԫ�صĵ縺�����������е縺��C<N<O��
�𰸣�C<N<O
��5���������ڲ��ǻ��Ĵ���ʹ�ô����Ӽ�����γ������ʹ�е����ߣ�ͪ����γ������
�𰸣��Ҵ����Ӽ�������
��6��CN-��N2�ǵȵ����壬CN-�Ľṹ�뵪�����ƣ�����ʽΪ![]() ��
��
�𰸣�![]()
��7����ͼ2��֪��Cu���aλ�õ�Feʱ�����ϵͣ����ȶ�����Cuλ�ڶ��㣬ԭ�Ӹ���Ϊ8��1/8=1��Feλ�����ģ�ԭ�Ӹ���Ϊ6��1/2=3��Nλ�����ģ���ֻ��1��N���仯ѧʽΪFe3CuN������������Ϊ![]() =
=![]() g�����������Ϊ��a��10-10��3=a3��10-30cm3�����ܶ�Ϊ
g�����������Ϊ��a��10-10��3=a3��10-30cm3�����ܶ�Ϊ ![]() ��
��
�𰸣�Fe3CuN ![]()

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
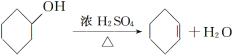

�����õ����й��������£�
��Է������� | �ܶ�/(g��cm��3) | �е�/�� | �ܽ��� | |
������ | 100 | 0.961 8 | 161 | ����ˮ |
����ϩ | 82 | 0.810 2 | 83 | ������ˮ |
�ϳɷ�Ӧ����a�м���20 g��������2СƬ���Ƭ����ȴ��������������1 mLŨH2SO4��b��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90 �档
�����ᴿ����Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10 g��
�ش��������⣺
��1��װ��b��������__________��
��2����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ_______��
��3���ڱ�ʵ���������У�����Ӧ�ôӷ�Һ©����_______(�����Ͽڵ����������¿ڷų���)��
��4�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ����______��
��5���ڻ���ϩ�ֲ�����������У��������õ���������____(����ȷ�𰸱��)��
A Բ����ƿ B �¶ȼ� C ����ƿ D ���������� E ������
��6���������ֻ���ϩ��Ʒ�ʹ�Ʒ�ķ�������������______��
a�������Ը��������Һ b���ý����� c���ⶨ�е�
����Ŀ��������[(CH3COO)2Ni]��һ����Ҫ�Ļ���ԭ�ϣ�һ���Ժ�������(�� NiS��Al2O3��FeO��CaO��SiO2)Ϊԭ�ϣ���ȡ�������Ĺ�������ͼ���£�

��������������������pH��������ʵ��ܽ��������
�������� | ��ʼ������pH | ������ȫ��pH | ���� | 20��ʱ�ܽ��ԣ�H2O�� | |
Fe3+ | 1.1 | 3.2 | CaSO4 | �� | |
Fe2+ | 5.8 | 8.8 | NiF | ���� | |
Al3+ | 3.0 | 5.0 | CaF2 | ���� | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp��9.6��10��6 |
(1)����pH�����У���ҺpH�ĵ��ڷ�Χ��___________��
(2)����1��Ҫ�ɷ���_______________������2��Ҫ�ɷ���_________________
(3)д�����������м���H2O2������Ӧ�����ӷ���ʽ_________��
(4)��������У�1mol NiSʧȥ6NA�����ӣ�ͬʱ����������ɫ�ж����塣д���÷�Ӧ�Ļ�ѧ����ʽ____________��
(5)���������У���c(Ni2+)=2.0mol/L����ʹ100mL����Һ�е�Ni2+��������ȫ��[c(Ni2+)��10��5 mol/L]������Ҫ����Na2CO3�������������Ϊ_____g������С�����1λ��
(6)���������������䣬�ڲ�ͬ�¶��¶Ժ������Ͻ�����������������ʱ��仯��ͼ�����������¶���ʱ��ֱ�Ϊ____________��