题目内容
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如图实验装置,请你参与探究,并回答问题:
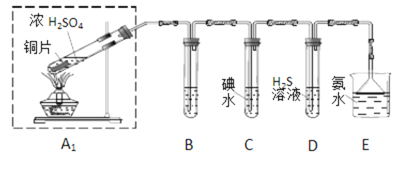
①装置B用于检验SO2的漂白性,其中所盛试剂为______,装置D用于检验SO2的________性质,该装置中反应的化学方程式为_________________________;
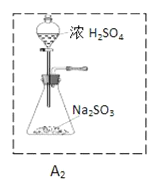
②为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写两点)_____________、____________;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。

①你认为哪个装置可行(填序号)_______,使用你所选用的装置测定SO2含量时,还需要测定的物理量是__________________;
②你认为哪个装置不可行(填序号)____,说明理由_______________。
【答案】品红溶液 氧化 SO2+2H2S=3S↓+2H2O 不用加热(节约能源,节约药品) 相对安全 a 当KMnO4溶液刚褪色时,测定通入空气的体积V b 空气中含有的CO2也能与碱石灰反应,造成测量不准确
【解析】
(1)①SO2具有漂白性,能使品红溶液褪色;在装置D中SO2与硫化氢发生反应SO2+2H2S=3S↓+H2O,根据元素化合价的变化判断物质的作用;
②使用装置A2的优点是不用加热,可以节约能源,相对安全,易于控制反应进行,反应更充分等;
(2)①二氧化硫能够被酸性KMnO4溶液氧化,可以测定空气中SO2含量;若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可;
②由于空气中含有的CO2也能与碱石灰反应,水蒸气也能被吸收,因此会造成测量不准确,所以b不可行。
(1)①装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性,装置B用品红溶液检验;
在装置D中发生反应:SO2+2H2S=3S↓+H2O,反应中SO2中的S元素化合价降低,得到电子,SO2作氧化剂,表现氧化性,H2S作还原剂,表现还原性;
②为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,使用装置A2的优点是不用加热,可以节约能源,相对安全;易于控制反应进行;反应更充分等;
(2)①对于装置a,将含有SO2的空气通入到KMnO4溶液中,只有SO2能发生反应,所以可以测定空气中SO2含量;若使用这种方法只需测定当KMnO4溶液恰好褪色时,测定通入空气的体积V即可,故合理装置序号是a;
②对于b,由于空气中含有的CO2也能与碱石灰反应,且其中含有的水蒸气也能被吸收,因此会造成测量不准确,不能用于测定空气中SO2含量。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
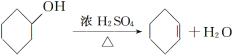

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________。
(2)本实验中最容易产生的副产物的结构简式为_______。
(3)在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____(填正确答案标号)。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(6)以下区分环己烯精品和粗品的方法,合理的是______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料,一种以含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10﹣6 |
(1)调节pH步骤中,溶液pH的调节范围是___________。
(2)滤渣1主要成分是_______________;滤渣2主要成分是_________________
(3)写出氧化步骤中加入H2O2发生反应的离子方程式_________。
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式____________。
(5)沉镍过程中,若c(Ni2+)=2.0mol/L,欲使100mL该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10﹣5 mol/L],则需要加入Na2CO3固体的质量最少为_____g(保留小数点后1位)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸。酸浸出率随时间变化如图。酸浸的最佳温度与时间分别为____________。