题目内容
(15分)可以由下列反应合成三聚氰胺:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______________________________________________________________________。
CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和________(填化学式),由此可以推知CN的空间构型为________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________________。
(3)三聚氰胺 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 后,
后,
三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
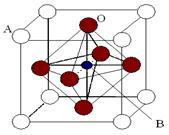
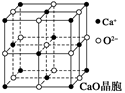
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________。
已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离 ________________ __(列出计算式)
CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是______________ ______。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______________________________________________________________________。
CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和________(填化学式),由此可以推知CN的空间构型为________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________________。
(3)三聚氰胺
 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 后,
后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________。

已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离 ________________ __(列出计算式)
CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是______________ ______。
(1)1s22s22p63s23p63d104s2或[Ar]3d104s2 (2分) CO2(1分) 直线形 (1分)
(2)sp2 (1分)COH2NNH2 (2分) (3)分子间氢键 (1分)(4)6 (2分)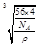 (3分)
(3分)
CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量(2分)
(2)sp2 (1分)COH2NNH2 (2分) (3)分子间氢键 (1分)(4)6 (2分)
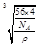 (3分)
(3分)CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量(2分)
试题分析:
(1) Ca在第四周期,核外有四层电子,最外层2个电子,则内层排满电子的基态原子的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,CN带16个电子,与CN互为等电子体的分子海有CO2,由此可以推知CN的空间构型与CO2相似为直线形;
(2) 尿素分子中C原子与氧原子结合成双键,与两个氮原子结合成单键,采取sp2杂化,尿素分子的结构简式为COH2NNH2;
(3) 聚氰胺分子中含有N元素,相互之间可通过分子间氢键结合;
(4) 由图可知,CaO晶体中Ca2+的配位数为6, CaO晶体和NaCl晶体都是离子晶体,晶格能差异的主要原因是CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
点评:本题考查物质的结构,涉及到分子结构、杂化轨道等抽象内容,具有一定难度。但此类题目近年来在高考中已被逐渐淡化。解答此类题型,要求考生具有丰富的想象力。

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
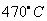 、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是