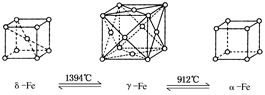
题目内容
下列各叙述中正确的是( )
| A.在氯化钠晶体中,每个Na+周围有6个Cl-,形成离子晶体 |
| B.在氯化钠晶体中存在NaCl分子 |
| C.石英是由SiO2形成的分子晶体 |
| D.金刚石和石墨晶体都是由碳原子形成的网状结构,是典型的原子晶体 |
A
【错解分析】错选CD,没有理解各晶体的结构特点,把CO2与SiO2的晶体类型相混淆;对石墨晶体一知半解。
【正解】在NaCl晶体中,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;在该晶体中只有阴离子和阳离子,没有NaCl分子,选项A的叙述正确,选项B不正确。成分为SiO2的石英是原子晶体,选项C的叙述不正确。石墨是层状结构,各层之间以分子间作用力相结合,且存在自由电子,具有传导性;而原子晶体的结构中微粒间都以共用电子对形成的共价键相结合,没有传导性。所以石墨不属于典型的原子晶体,可称混合晶体,选项D不正确。

练习册系列答案
相关题目
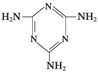 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸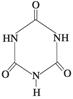 后,
后,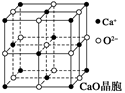

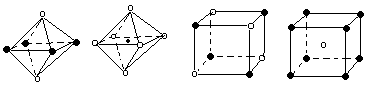
 原子周围距离最近的
原子周围距离最近的 原子有 个。
原子有 个。
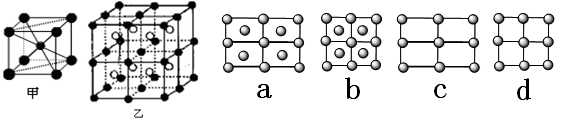
 =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。