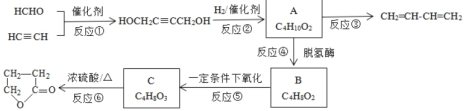
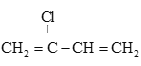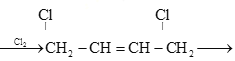题目内容
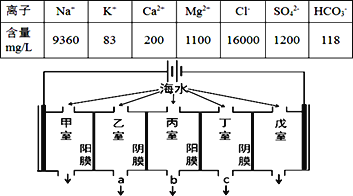
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl26H2O的流程如图:

(1)海水淡化的方法有蒸馏法、___(任写一种)等,考虑成本及效益试剂①可选用___。
(2)比较溶液中Br2的浓度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是__。
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作包括____。
【答案】电渗析法(或离子交换法) CaO或Ca(OH)2 < SO2+Br2+2H2O=2HBr+H2SO4 蒸发浓缩,降温结晶
【解析】
由流程图可知,向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,过滤;向溶液1中通入氯气,氯气与溶液中的溴离子发生置换反应生成含有浓度较低单质溴的溶液2,用空气和水蒸气吹出溴蒸气,溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸的溶液3,再向所得溶液3通入氯气得到含溴浓度较高的溶液4,将氢氧化镁溶于盐酸中得到氯化镁溶液,氯化镁溶液蒸发浓缩,冷却结晶,过滤得到六水氯化镁。
(1)海水淡化的方法主要有蒸馏法、离子交换法、电渗析法等。向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,考虑成本及效益试剂①可以选用CaOH)2或生石灰,故本题答案为:电渗析法(或离子交换法);CaO或Ca(OH)2;
(2)由分析可知,溶液2含有单质溴浓度低于溶液4,故本题答案为:<;
(3)由分析可知,溶液中溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸,反应的化学方程式为SO2+Br2+2H2O=2HBr+H2SO4,故本题答案为:SO2+Br2+2H2O=2HBr+H2SO4;
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作是蒸发浓缩,冷却结晶,过滤等操作,故本题答案为:蒸发浓缩,降温结晶。

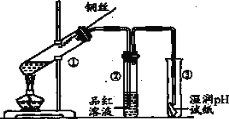
【题目】—氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
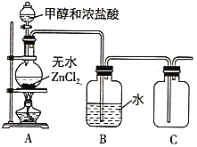
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①装置B的主要作用是_____。
②以无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为____。如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mLc1mol/LNaOH溶液充分吸收,以甲基橙作指示剂,用c2mol/L盐酸标准液对吸收液进行滴定,最终消耗V2mL盐酸,则所收集CH3Cl的物质的量为_____mol。(已知:2CH3Cl+3O2=2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C-Cl | C-Br |
键能/(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:_____。
②设计实验证明HBr是强酸:____(简要说明实验操作、现象和结论)
③CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中的键能和Ksp数据解释原因:____。
【题目】(1)氢气可由天然气和水反应制备,其主要反应为CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),反应过程中能量变化如图所示:
CO2(g)+4H2(g),反应过程中能量变化如图所示:
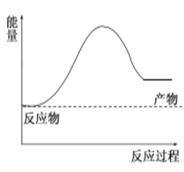
(1)若已知某些化学键的键能用字母表示如表:(计算用含a、b、c、d字母表示)。根据该反应制取1molH2要吸收或放出热量为__________
化学键 | C-H | O-H | C=O | H-H |
键能(kJ/mol) | a | b | c | d |
(2)在恒温恒容条件下反应,能说明该反应已达到平衡状态的是______________。
a.2v正(CO2)=v逆(H2O)
b.容器内密度不再发生变化
c.平均相对分子质量不再发生变化
d.当4molC-H键断裂时,同时又2molC=O键断裂
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
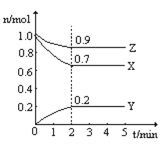
①该反应的化学方程式为__________
②反应开始至2min,气体Y的平均反应速率为__________
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为__________。