题目内容
16.下列说法正确的是( )| A. | CCl4是正四面体形 | |
| B. | H2O分子中氧原子为sp3杂化,其分子几何构型为V形 | |
| C. | 二氧化碳中碳原子为sp2杂化,为直线形分子 | |
| D. | NH4+是三角锥形 |
分析 A、判断CCl4中C原子的价层电子对数,再判断空间构型;
B、判断水中O原子的价层电子对数,再判断杂化类型;
C、判断二氧化碳中C原子的价层电子对数,再判断杂化类型和空间构型;
D、判断NH4+中N原子的价层电子对数,再判断杂化类型和空间构型.
解答 解:A、CCl4中C原子的价层电子对数为4,则为正四面体形,故A正确;
B、H2O分子中O原子的价层电子对数=2+$\frac{1}{2}$(6-1×2)=4,为sp3杂化,含有2个孤电子对,分子为V形,故B正确;
C、二氧化碳中C原子的价层电子对数=2+$\frac{1}{2}$(4-2×2)=2,为sp杂化,分子为直线形,故C错误;
D、NH4+中N原子的价层电子对数=4+$\frac{1}{2}$(5-1+4×1)=4,为sp3杂化,不含有孤电子对,为正四面体形,故D错误.
故选AB.
点评 本题考查了微粒空间构型和原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,难度不大.

练习册系列答案
相关题目
17.室温下,pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH值( )
| A. | 一定小于7 | B. | 一定等于7 | C. | 一定大于7 | D. | 无法判断 |
7.现有一种烃可表示为 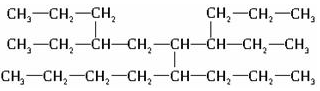 该烃主链的碳原子数应是
该烃主链的碳原子数应是
( )
 该烃主链的碳原子数应是
该烃主链的碳原子数应是( )
| A. | 11 | B. | 9 | C. | 10 | D. | 12 |
4.一种具有除草功效的有机物的结构简式如图所示.下列有关该化合物的说法正确的是( )

| A. | 该分子式为C19H16O7 | |
| B. | 能发生氧化、取代、消去反应 | |
| C. | 1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
11.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电,下列有关K3C60的结构和性质的分析正确的是( )
| A. | 该物质属于离子晶体,且1molK3C60中含有的离子键的数目为63NA | |
| B. | 该物质属于原子晶体,具有很高的熔点 | |
| C. | K3C60的摩尔质量是837 | |
| D. | K3C60和C60中都含有共价键 |
1.下列关于有机化合物的说法正确的是( )
| A. | 油脂和蛋白质都属于高分子化合物 | |
| B. | 丁烷有3种同分异构体 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
8.下列叙述正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 | |
| B. | 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA | |
| C. | 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 金属钠着火时使用泡沫灭火器灭火 |
5.已知断裂1mol共价键所需要吸收的能量分别为H-H:436kJ,I-I:151kJ,H-I:299kJ,下列对H2(g)+I2(g)?2HI(g)的反应类型判断错误的是( )
| A. | 吸收能量的反应 | B. | 放出能量的反应 | C. | 氧化还原反应 | D. | 可逆反应 |
6.乙醇分子结构中各化学键如图所示.关于乙醇 在各种反应中断键说法不正确的是( )
在各种反应中断键说法不正确的是( )
 在各种反应中断键说法不正确的是( )
在各种反应中断键说法不正确的是( )| A. | 在银催化条件下与O2反应时断裂①和③ | |
| B. | 乙醇燃烧是断裂②和⑤ | |
| C. | 和金属钠反应时①断裂 | |
| D. | 和浓H2SO4、乙酸共热时断裂① |