题目内容
8.下列叙述正确的是( )| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 | |
| B. | 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA | |
| C. | 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| D. | 金属钠着火时使用泡沫灭火器灭火 |
分析 A、钠在通常条件下反应生成氧化钠;
B、求出钠的物质的量,然后根据钠元素的化合价变化来分析;
C、钠和水反应生成氢氧化钠和水;
D、金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应.
解答 解:A、钠在通常条件下反应生成氧化钠,点燃条件生成过氧化钠,故A错误;
B、2.3g钠的物质的量为0.1mol,而钠无论反应后产物是什么,钠元素反应后一定变为+1价,故0.1mol钠失去0.1NA电子,故B错误;
C、钠和水反应生成氢氧化钠和水,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故C正确;
D、金属钠着火生成过氧化钠,与泡沫灭火器喷出的二氧化碳反应,反应生成的氧气助燃,不能灭火,应利用沙土铺盖,故D错误;
故选C.
点评 本题考查物质性质的分析应用,反应条件和产物的判断,金属钠性质的分析应用是解题关键,题目较简单.

练习册系列答案
相关题目
9.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
19.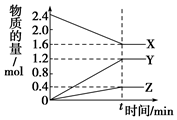 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )| A. | 该反应的化学方程式为:2X?3Y+Z | |
| B. | 10s内Y的平均速率为0.12 mol•L-1•min-1 | |
| C. | X的转化率为66.7% | |
| D. | 增大压强,该反应速率一定加快 |
16.下列说法正确的是( )
| A. | CCl4是正四面体形 | |
| B. | H2O分子中氧原子为sp3杂化,其分子几何构型为V形 | |
| C. | 二氧化碳中碳原子为sp2杂化,为直线形分子 | |
| D. | NH4+是三角锥形 |
3.下列关于有机化合物的说法正确的是( )
| A. | 以淀粉为原料制取乙酸乙酯 | |
| B. | 油脂的皂化反应属于加成反应 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,蛋白质均变性 |
13.下列说法正确的是( )
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 将FeCl3溶液加热蒸干可以制取较纯净的FeCl3固体 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
20.下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2②CH3CH2CH═CH2③ ④CH3CH3.
④CH3CH3.
①SO2②CH3CH2CH═CH2③
 ④CH3CH3.
④CH3CH3.| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
17.目前,全球有16亿人有不同程度的缺碘现象,其中包括6亿儿童.科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活.目前预防缺碘的有效办法是食用含碘食盐.这种食盐含( )
| A. | 单质碘(I2) | B. | 碘化钠中化合态的碘(I-) | ||
| C. | 碘酸钠中的碘元素 | D. | 氯化碘(ICl)中的碘元素 |