题目内容
11.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质熔融状态下能导电,下列有关K3C60的结构和性质的分析正确的是( )| A. | 该物质属于离子晶体,且1molK3C60中含有的离子键的数目为63NA | |
| B. | 该物质属于原子晶体,具有很高的熔点 | |
| C. | K3C60的摩尔质量是837 | |
| D. | K3C60和C60中都含有共价键 |
分析 A.该物质在熔融状态下能导电,则为离子晶体,1molK3C60中含有3mol阳离子,1mol阴离子;
B.该物质熔融状态下能导电属于离子晶体;
C.摩尔质量的单位为g/mol;
D.非金属元素之间易形成共价键.
解答 解:A.1molK3C60中含有3mol阳离子,1mol阴离子,则1molK3C60中含有的阴阳离子的数目为4NA,故A错误;
B.该物质熔融状态下能导电,说明是电解质且含有离子键,所以属于离子晶体,故B错误;
C.摩尔质量的单位为g/mol,则K3C60的摩尔质量是837g/mol,故C错误;
D.C603-和C60中C-C键为共价键,所以K3C60和C60中都含有共价键,故D正确;
故选D.
点评 本题以信息考查化学键,明确盐的组成、化学键的形成是解答本题的关键,注意阴离子为C60形成的阴离子,为学生解答中的难点和易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.在密闭容器中,反应2A+B?2C达到平衡后,增大压强,平衡向生成C的方向移动.对于A、B、C三种物质的状态判断正确的是( )
| A. | A是气体 | B. | B是气体 | ||
| C. | 如果C是气体,A、B一定是气体 | D. | 如果C是气体,B不一定是气体 |
19.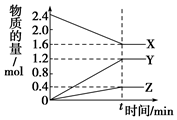 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )| A. | 该反应的化学方程式为:2X?3Y+Z | |
| B. | 10s内Y的平均速率为0.12 mol•L-1•min-1 | |
| C. | X的转化率为66.7% | |
| D. | 增大压强,该反应速率一定加快 |
6.下列离子方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO2+H2O?HCO3-+H+ | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | HS-+H2O?S2-+H3O+ |
16.下列说法正确的是( )
| A. | CCl4是正四面体形 | |
| B. | H2O分子中氧原子为sp3杂化,其分子几何构型为V形 | |
| C. | 二氧化碳中碳原子为sp2杂化,为直线形分子 | |
| D. | NH4+是三角锥形 |
3.下列关于有机化合物的说法正确的是( )
| A. | 以淀粉为原料制取乙酸乙酯 | |
| B. | 油脂的皂化反应属于加成反应 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,蛋白质均变性 |
20.下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2②CH3CH2CH═CH2③ ④CH3CH3.
④CH3CH3.
①SO2②CH3CH2CH═CH2③
 ④CH3CH3.
④CH3CH3.| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
1.向复盐明矾[KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀,反应的离子方程式正确的是( )
| A. | Ba2++SO42-=BaSO4↓ | |
| B. | 2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ | |
| C. | Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ | |
| D. | Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
 硫酸工业在国民经济中占有极其重要的地位.
硫酸工业在国民经济中占有极其重要的地位.