题目内容
【题目】CO 和 NO 是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展, 汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H ______0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJmol -1
C(s) + O2 (g)=CO2 (g) △H= b kJmol -1
2C(s) + O2 (g)=2CO(g) △H= c kJmol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=______kJmol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 a molCO、b molNO 充入一恒压真空密闭容器。已知起始压强为 c kPa,到达平衡时, 测得N2 的物质的量为 d mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=_____(用含 a、b、c、d 的式子表示)
②该条件下,可判断此反应到达平衡的标志是_____。
A.单位时间内,断裂 2n molC=0 同时形成 n mol N≡N
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2 的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:
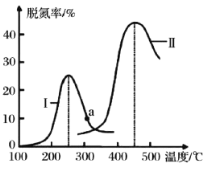
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为_____________。
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为________。
(5)己知常温下, Kb(NH3·H 2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11。此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)= ____mol/L,将脱氮反应后生成CO2 通入氨水中使溶液恰好呈中性,则此时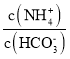 =____________(保留小数点后4位数字)
=____________(保留小数点后4位数字)
【答案】< 2b-a-c ![]() BC 催化剂 II,450℃ 温度较低时,催化剂 I 的活性偏低 6×10-3 1.0009
BC 催化剂 II,450℃ 温度较低时,催化剂 I 的活性偏低 6×10-3 1.0009
【解析】
(1)反应自发进行的判断依据为△H-T△S<0;
(2)根据盖斯定律,得到目标方程式的计算式为2×②-①-③,据此计算△H2;
(3)①根据Kp=![]() 计算平衡分压代替平衡浓度的平衡常数;
计算平衡分压代替平衡浓度的平衡常数;
②结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(4)①由图象的脱氮率观察适当反应条件;
②催化剂在低温下活性不大,反应随温度变化速率变化不大;
(5)NH3H2O的Kb=1.8×10-5,若氨水的浓度为2.0molL-1,可结合Kb=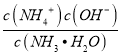 计算c(OH-),将CO2通入该氨水中,当溶液呈中性时溶液中c(OH-)=c(H+)=10-7mol/L,电荷守恒得到:c(NH4+)=c(HCO3-)+2c(CO32-),
计算c(OH-),将CO2通入该氨水中,当溶液呈中性时溶液中c(OH-)=c(H+)=10-7mol/L,电荷守恒得到:c(NH4+)=c(HCO3-)+2c(CO32-),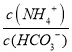 =1+
=1+![]() ,H2CO3的Ka2=4.4×10-11,结合Ka2=
,H2CO3的Ka2=4.4×10-11,结合Ka2=![]() 计算
计算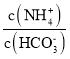 。
。
(1)反应 2NO(g)+2CO(g)2CO2(g)+N2(g)能够自发进行,反应△S<0,若满足△H-T△S<0,必须△H<0,故答案为:<;
(2)根据盖斯定律,得到目标方程式的计算式为2×②-①-③,代入a、b、c计算得△H=2b-a-c,
故答案为:2b-a-c;
(3)①根据三段式,
![]()
![]() n(起始)/mol
n(起始)/mol![]()
n(改变)/mol![]()
n(平衡)/mol![]()
平衡时,NO和CO的体积分数都等于![]() ,CO2的体积分数为
,CO2的体积分数为![]() ,N2的体积分数为
,N2的体积分数为![]() ,因为是恒压容器,故平衡时的总压也为c kPa,Kp=
,因为是恒压容器,故平衡时的总压也为c kPa,Kp=![]() =
= =
=![]() ,故答案为:
,故答案为:![]() ;
;
②A.单位时间内,断裂 2n molC=0 同时形成 n mol N≡N,正反应速率和逆反应速率不相等,不能说明达到平衡,故A错误;
B.该反应是气体分子数不相等的反应,混合气体的平均相对分子质量不再改变,可以说明达到平衡,故B正确;
C. 容器是恒压容器, 反应是气体分子数不相等的反应,混合气体的密度不再改变可以说明达到平衡,故C正确;
故答案为BC。
(4)①由图象可知,在催化剂 II,450℃条件下达到最大脱氮率,故答案为:催化剂 II,450℃;
②温度较低时,催化剂的活性偏低,反应速率慢,所以脱氮率随温度升高变化不大,故答案为:温度较低时,催化剂的活性偏低;
(5)NH3H2O的Kb=1.8×10-5,若氨水的浓度为2.0molL-1,由Kb=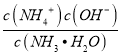 ,可知c(OH-)=
,可知c(OH-)=![]() mol/L=6×10-3mol/L,将CO2通入该氨水中,当溶液呈中性时溶液中c(OH-)=c(H+)=10-7mol/L,电荷守恒得到:c(NH4+)=c(HCO3-)+2c(CO32-),
mol/L=6×10-3mol/L,将CO2通入该氨水中,当溶液呈中性时溶液中c(OH-)=c(H+)=10-7mol/L,电荷守恒得到:c(NH4+)=c(HCO3-)+2c(CO32-),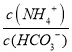 =1+
=1+![]() ,H2CO3的Ka2=4.4×10-11,结合Ka2=
,H2CO3的Ka2=4.4×10-11,结合Ka2=![]() 计算
计算![]() ,
,![]() =
=![]() =
=![]() ,
,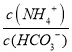 =1+
=1+![]() =1+
=1+![]() =1.0009,故答案为:6×10-3;1.0009。
=1.0009,故答案为:6×10-3;1.0009。