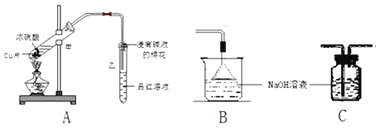
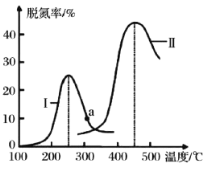
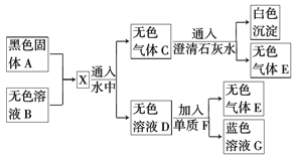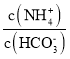题目内容
【题目】NaNO3和Cu(NO3)2的混合溶液体积为500mL,测得其中c(NO3-)=6.0mol·L-1,用铂电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.电解得到铜的物质的量为0.5mol
B.上述电解过程中共转移2mol电子
C.原混合溶液中c(Na+)为2mol·L-1
D.电解后溶液中c(H+)为2mol·L-1
【答案】C
【解析】
阳极始终是溶液中的OH-放电生成氧气,阴极首先是溶液中的铜离子放电,生成铜单质,然后是溶液中的氢离子放电生成氢气。根据题意可知氢气和氧气的物质的量都是1mol,则根据电子的得失守恒可知,析出铜的物质的量是1mol,溶液中NO3-的物质的量是3mol,所以依据溶液的电中性可知,
A、电解得到铜的物质的量为1mol,选项A错误;
B、上述电解过程中共转移电子的物质的量是4mol,选项B错误;
C、硝酸钠的物质的量是1mol,则原混合溶液中c(Na+)为![]() =2 mol/L,选项C正确;
=2 mol/L,选项C正确;
D、电解后溶液中c(H+)为![]() =4mol/L,选项D错误;
=4mol/L,选项D错误;
答案选C。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目