题目内容
【题目】硫酸亚铁溶液和过量碳酸氢铵溶液混合,过滤、洗涤、干燥得到碳酸亚铁,在空气中灼烧碳酸亚铁得到铁的氧化物M。利用滴定法测定M的化学式,其步骤如下:
①称取3.92g样品M溶于足量盐酸,并配成100mL溶液A。
②取20.00mL溶液A于锥形瓶中,滴加KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生气泡。
③待气泡消失后,用1.0000 mol·L-1 KI标准溶液滴定锥形瓶中的Fe3+,达到滴定终点时消耗KI标准溶液10.00 mL。
(1)实验中必需的定量仪器有量筒、电子天平、____________和____________。
(2)在滴定之前必须进行的操作包括用标准KI溶液润洗滴定管、__________、___________。
(3)步骤②中“气泡”有多种可能,完成下列猜想:
①提出假设:
假设1:气泡可能是SCN-的反应产物N2、CO2、SO2或N2,CO2。
假设2:气泡可能是H2O2的反应产物____________,理由___________。
②设计实验验证假设1:
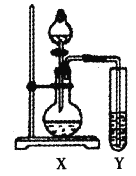
试管Y中的试剂是_______。
(4)根据上述实验,写出硫酸亚铁溶液和过量碳酸氢铵溶液混合制备碳酸亚铁的离子方程式_____。
(5)根据数据计算,M的化学式为_______。
(6)根据上述实验结果,写出碳酸亚铁在空气中灼烧的化学方程式________。
【答案】100mL容量瓶 滴定管 排出玻璃尖嘴的气泡 调节液面至0刻度线或0刻度线以下某一刻度 O2 H2O2在催化剂作用下分解产生O2 澄清石灰水 Fe2+ + 2HCO3- =FeCO3↓+CO2↑+H2O Fe5O7 5FeCO3+O2![]() Fe5O7+5CO2
Fe5O7+5CO2
【解析】
(1)根据实验操作选择缺少的定量仪器,该实验第①步为配制100mL溶液,第③步为滴定实验,据此分析判断;
(2)根据滴定管的使用方法进行解答;
(3)①过氧化氢在铁离子催化作用下分解生成氧气;
②气泡可能是SCN-的反应产物N2、CO2、SO2或N2、CO2,可以利用二氧化碳通入石灰水变浑浊判断;
(4)硫酸亚铁溶液和过量碳酸氢铵溶液混合反应生成碳酸亚铁、二氧化碳和水;
(5)利用反应2I-+2Fe3+=2Fe2++I2的定量关系计算铁元素物质的量,进而计算氧元素物质的量,从而确定化学式;
(6)碳酸亚铁在空气中灼烧生成铁的氧化物和二氧化碳,结合原子守恒配平化学方程式。
(1)该实验第①步为配制100mL溶液,缺少的定量仪器有100mL容量瓶;第③步为滴定实验,缺少的定量仪器为滴定管,故答案为:100mL容量瓶;滴定管;
(2)滴定管在使用之前,必须检查是否漏水,若不漏水,然后用水洗涤滴定管,再用待装液润洗,然后加入待装溶液,排出玻璃尖嘴的气泡,再调节液面至0刻度线或0刻度线以下某一刻度,读数后进行滴定,故答案为:排出玻璃尖嘴的气泡;调节液面至0刻度线或0刻度线以下某一刻度;
(3)①假设2:气泡可能是H2O2的反应产物为O2,H2O2在催化剂铁离子作用下分解产生O2,故答案为:O2;H2O2在催化剂作用下分解产生O2;
②假设1为气泡可能是SCN-的反应产物N2、CO2、SO2或N2,CO2,则试管Y中的试剂可以是澄清石灰水,用于检验气体,若假设成立,气体通入后会变浑浊,故答案为:澄清石灰水;
(4)硫酸亚铁溶液和过量碳酸氢铵溶液混合反应生成碳酸亚铁、二氧化碳和水,反应的离子方程式为Fe2+ + 2HCO3- =FeCO3↓+CO2↑+H2O;故答案为:Fe2+ + 2HCO3- =FeCO3↓+CO2↑+H2O;
(5)根据反应2I+2Fe3+=2Fe2++I2,可得关系式:I ~ Fe3+,在20mL溶液中n(Fe3+)=1.0000mol/L×0.01L×100=0.01mol,则100mL溶液中铁离子物质的量为0.05mol,则铁的氧化物中氧元素物质的量![]() ,则n(Fe):n(O)=0.05:0.07=5:7,化学式为:Fe5O7,故答案为:Fe5O7;,
,则n(Fe):n(O)=0.05:0.07=5:7,化学式为:Fe5O7,故答案为:Fe5O7;,
(6)碳酸亚铁在空气中灼烧和氧气反应生成Fe5O7和二氧化碳,反应的化学方程式:5FeCO3+O2![]() Fe5O7+5CO2,故答案为:5FeCO3+O2
Fe5O7+5CO2,故答案为:5FeCO3+O2![]() Fe5O7+5CO2。
Fe5O7+5CO2。

【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀