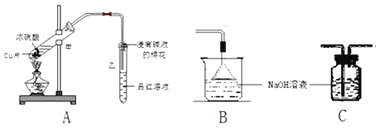
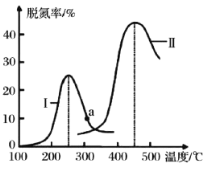
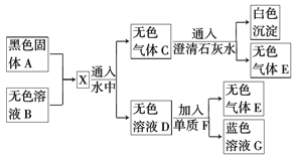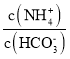��Ŀ����
����Ŀ���ȴ��ϳɰ����ٵ����������ǣ����ø�������Ӧ���ʵ�ͬʱ����ƽ�����Ƶ��� NH3 ���ʽ��͡��ҹ�������Ա������ Ti-H-Fe ˫��������(Ti-H ����� Fe ������¶Ȳ�ɳ��� 100��)��Ti-H-Fe ˫�������ϳɰ��ķ�Ӧ������ͼ�����������ڴ��������ϵ�������*��ע������˵����ȷ����

A.��Ϊ���������Ķ��ѹ���
B.�٢ڢ��ڸ������������ܢ��ڵ���������
C.��ΪN ԭ���� Fe ������ Ti-H ����Ĵ��ݹ���
D.ʹ�� Ti-H-Fe ˫��������ʹ�ϳɰ���Ӧת��Ϊ���ȷ�Ӧ
���𰸡�B
��������
A�������ٹ���֮�������ӱ�������������û�б�ɵ�ԭ�ӣ�����N��N�Ķ��ѹ��̣���A����
B����Ϊ��������N2�Ĺ��̣���Ϊ�γɹ���̬�Ĺ��̣���ΪN2����ΪN�Ĺ��̣����϶���Ҫ�ڸ���ʱ���У�Ŀ���Ǽӿ췴Ӧ���ʣ���ԭ�ӵ�ת�ƣ���ѧ�������ɣ���Ҫ����������Ŀ������������ƽ����ʣ��ܢ��ڵ�����������Ϊ������ƽ����ʣ���B��ȷ��
C��������ͼʾ��֪�����̢������Ti-H-Fe��*N��Ti-H��*N-Fe���ֹ���̬��ת����Nԭ����Fe������Ti-H���ݣ���ΪN2����ΪN�Ĺ��̣���C����
D�������ܸı仯ѧ��Ӧ���ʣ������ܸı䷴Ӧ���ʱ䣬��D����
��ѡB��

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ��ijС��ͬѧͨ��ʵ���о�FeCl3��Һ��Cu�۷�����������ԭ��Ӧ��ʵ���¼���£�
��� | I | II | III |
ʵ�鲽�� |
���������2mL����ˮ |
���������2mL����ˮ |
���������2mL����ˮ |
ʵ������ | ͭ����ʧ����Һ��ɫ��dz����������ˮ������������ | ͭ����ʣ�࣬��Һ��ɫ��ȥ����������ˮ�����ɰ�ɫ���� | ͭ����ʣ�࣬��Һ��ɫ��ȥ�������ɫ����������ˮ���ް�ɫ���� |
����˵������ȷ����
A. ʵ��I��II��III�о��漰Fe3+����ԭ
B. �Ա�ʵ��I��II˵����ɫ�����IJ�����ͭ�۵����й�
C. ʵ��II��III�м�������ˮ��c(Cu2+)��ͬ
D. ��ʵ��III��Ӧ�����Һ�м��뱥��NaCl��Һ���ܳ��ְ�ɫ����