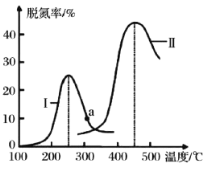
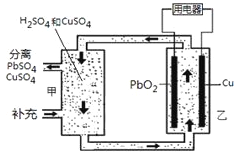
题目内容
【题目】Cl2通入足量的氢氧化钠溶液,温度不同时充分反应后产物溶液中除大量OH-外,还有Cl-、ClO-、ClO3-,已知:Cl2+OH-→Cl-+ClO-+H2O(冷碱)、Cl2+OH-→Cl-+ClO3-+H2O(热碱),并知ClO-、ClO3-离子的物质的量比为2:1,试问原混合气体中Cl2与反应后溶液中的Cl-物质的量之比为( )
A.2:5B.3:1C.1:1D.5:7
【答案】D
【解析】
Cl2生成ClO与ClO3是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO与ClO3的物质的量浓度之比为2:1,则可设![]() 为2mol,ClO3为1mol,失去电子的总物质的量为2mol×(1-0)+1mol×(5-0)=7mol。氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成Cl是被还原的过程,化合价由0价降低为1价,则得到电子的物质的量也应为7mol,即生成的Cl的物质的量为
为2mol,ClO3为1mol,失去电子的总物质的量为2mol×(1-0)+1mol×(5-0)=7mol。氧化还原反应中氧化剂和还原剂之间得失电子数目相等,Cl2生成Cl是被还原的过程,化合价由0价降低为1价,则得到电子的物质的量也应为7mol,即生成的Cl的物质的量为![]() ,则参加反应的氯气是
,则参加反应的氯气是![]() ,据此分析。
,据此分析。
据分析可知, 原混合气体中Cl2与反应后溶液中的Cl-物质的量之比为5:7;
故答案选D。

练习册系列答案
相关题目