题目内容
常温下,0.1 mol·L-1某一元酸(HA)溶液中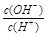 =1×10-6,下列叙述正确的是
=1×10-6,下列叙述正确的是
A.加水稀释,溶液的c(OH-)增大
B.此时,HA的电离平衡常数约为10-8
C.溶液中水电离出的H+的物质的量浓度约为10-10 mol·L-1
D.与0.05 mol·L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
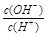 =1×10-6,下列叙述正确的是
=1×10-6,下列叙述正确的是A.加水稀释,溶液的c(OH-)增大
B.此时,HA的电离平衡常数约为10-8
C.溶液中水电离出的H+的物质的量浓度约为10-10 mol·L-1
D.与0.05 mol·L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
AC
根据水的离子积常数和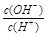 =1×10-6可知,氢离子浓度为1×10--4mol/L,因此酸是弱酸,稀释有利于电离,但溶液的酸性会降低,碱性会增强,A正确。溶液中c(OH-)为10-10 mol·L-1,所以由水电离出的H+的物质的量浓度也为10-10 mol·L-1,C正确。此时,HA的电离平衡常数约为
=1×10-6可知,氢离子浓度为1×10--4mol/L,因此酸是弱酸,稀释有利于电离,但溶液的酸性会降低,碱性会增强,A正确。溶液中c(OH-)为10-10 mol·L-1,所以由水电离出的H+的物质的量浓度也为10-10 mol·L-1,C正确。此时,HA的电离平衡常数约为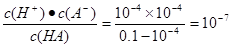 ,B不正确。在选项D中酸是过量的,根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),因此D不正确。所以答案选AC。
,B不正确。在选项D中酸是过量的,根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),因此D不正确。所以答案选AC。
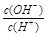 =1×10-6可知,氢离子浓度为1×10--4mol/L,因此酸是弱酸,稀释有利于电离,但溶液的酸性会降低,碱性会增强,A正确。溶液中c(OH-)为10-10 mol·L-1,所以由水电离出的H+的物质的量浓度也为10-10 mol·L-1,C正确。此时,HA的电离平衡常数约为
=1×10-6可知,氢离子浓度为1×10--4mol/L,因此酸是弱酸,稀释有利于电离,但溶液的酸性会降低,碱性会增强,A正确。溶液中c(OH-)为10-10 mol·L-1,所以由水电离出的H+的物质的量浓度也为10-10 mol·L-1,C正确。此时,HA的电离平衡常数约为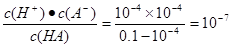 ,B不正确。在选项D中酸是过量的,根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),因此D不正确。所以答案选AC。
,B不正确。在选项D中酸是过量的,根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),因此D不正确。所以答案选AC。
练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
 =10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是
=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是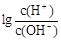 ,则80℃时,该Ba(OH)2溶液的酸度AG=______________。(结果保留对数形式)
,则80℃时,该Ba(OH)2溶液的酸度AG=______________。(结果保留对数形式)