题目内容
下列有关实验操作中,正确的是
| A.用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B.银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C.向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
D
试题分析:A、实验室取用化学药品一般不能放回原瓶,错误;B、实验过程中产生的废液应放置在废液桶中,不能随便倒掉,错误;C、胶头滴管应垂直滴加,不能靠在器皿壁上造成污染,错误;D、正确。

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
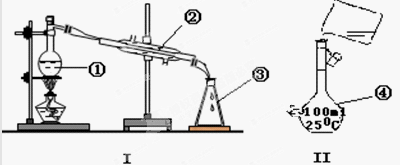
 溶液的浓缩结晶
溶液的浓缩结晶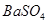 中
中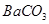
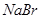 溶液中少量
溶液中少量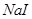
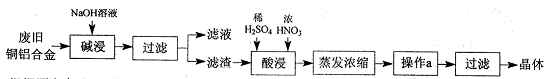
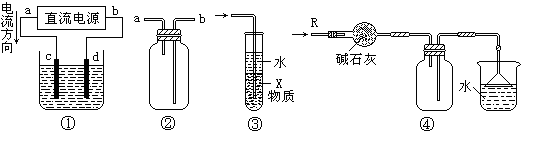

 g/cm3 ),需取用36.5% (
g/cm3 ),需取用36.5% ( g/cm3 )的盐酸 mL
g/cm3 )的盐酸 mL