题目内容
【题目】已知:镁电池的总反应为xMg+Mo3S4![]() MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S![]() Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是

A. 锂电池放电时,Mg2+向负极迁移
B. 镁电池放电时,正极发生的电极反应为Mo3S4+xMg2++2xe-==MgxMo3S4
C. 理论上两种电池的比能量相同
D. 图中Li作负极,Mo3S4作阳极
【答案】B
【解析】A. 锂电池放电时,镁电极失去电子生成Mg2+向阴极迁移,A错误;B. 镁电池放电时,正极发生的电极反应为Mo3S4+xMg2++2xe-==MgxMo3S4,B正确;C. 镁、锂的摩尔质量不是2倍关系,两种电池的比能量不同,C错误;D. 由电子流动方向判断可知,图中Li 作负极,Mo3S4作阴极,D错误。答案选B。

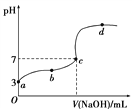
【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是__________,B是____________(填化学式) 。
(2)写出C和D反应的离子方程式________________。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=____________________(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是________________。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是______。
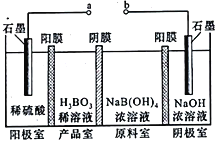
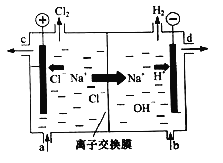
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜