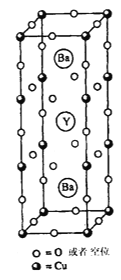
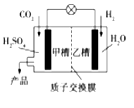
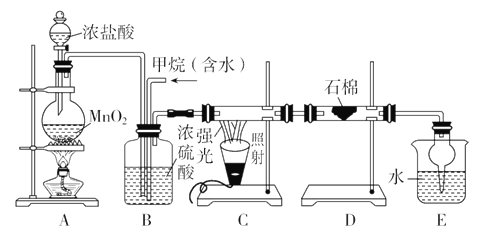
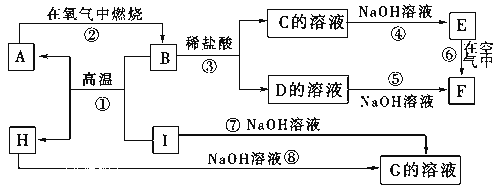
题目内容
【题目】向Fe和Fe2O3组成的6.56 g混合物中加入100 mL某浓度的盐酸,恰好完全反应,生成896mLH2(标准状况下),若向反应后的溶液中滴入几滴KSCN溶液,溶液不呈红色。求:
(1)原混合物中Fe2O3的质量分别为______,Fe的质量为________。
(2)原盐酸的物质的量浓度____________。
【答案】3.20 g 3.36g 2.0 mol /L
【解析】
(1)设原混合物中Fe、Fe2O3的物质的量分别为x、y ,混合物中加入盐酸,反应的有关方程式是Fe2O3 + 6H+=2Fe3+ + 3H2O 2Fe3+ + Fe = 3Fe2+ Fe + 2H+= Fe2+ + H2↑,反应放出氢气的物质的量为:![]() ,
,
根据方程式中物质间的关系可得方程x-y= 0.04mol,根据原固体质量可得56x+160y =6.56g
解得x=0.06mol,y=0.02mol,所以原混合物中Fe的质量为m(Fe)=0.06mol×56g/mol=3.36g,含有的Fe2O3质量为m(Fe2O3)=0.02mol×160g/mol=3.20g;
(2)由于反应后溶液中只有FeCl2,故根据元素守恒,可知参与反应的HCl物质的量为:n(HCl)=2n(FeCl2)=2n(Fe)+4n (Fe2O3)=2×0.06mol+4×0.02mol=0.20mol,则c(HCl)=![]() 。
。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目