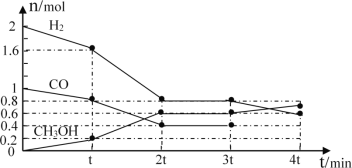
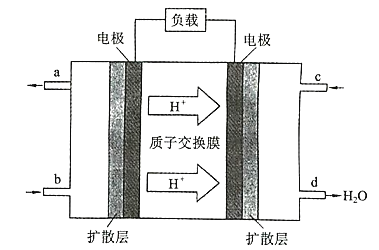
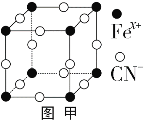
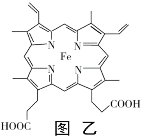
题目内容
【题目】我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是( )
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
【答案】B
【解析】
根据电池总反应可知,铝板中的铝化合价升高,失去电子,作负极,发生的电极反应式为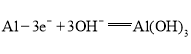 ,铂网作正极,氧气在正极上发生反应,电极反应式为
,铂网作正极,氧气在正极上发生反应,电极反应式为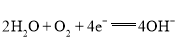 ,结合选项分析即可。
,结合选项分析即可。
A.氧气在正极上发生反应,电极反应式为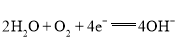 ,A选项正确;
,A选项正确;
B.原电池工作时,铂网作正极,铝板作负极,电流由正极铂电极沿导线流向负极铝电极,B选项错误;
C.网状的铂可以增大其与氧气的接触面积,加快反应速率,C选项正确;
D.Al作负极,工作时会失电子而损耗,故该电池只需更换铝板便可继续使用,D选项正确;
答案选B。

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ