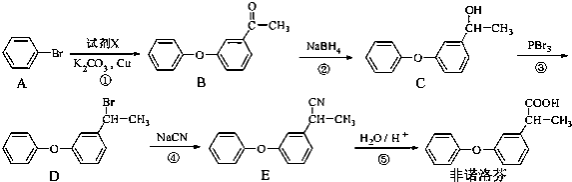
题目内容
【题目】下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答下列问题:

(1)元素③形成的单质的电子式为_________;元素②形成的最高价氧化物的结构式为________。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强的是_________(填化学式),沸点最高的是__________(填化学式)。
(3)元素⑩在周期表中的位置_________;该元素的单质主要用途________(填一种)。
(4)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较__________(填化学式)。
(5)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为___________。
(6)用电子式表示⑥、⑧两元素结合成化合物的形成过程__________________。
【答案】 ![]() O=C=O HF H2O 第四周期IVA族 作半导体 HClO4>H2SO4 Al(OH)3+OH-=AlO2-+2H2O
O=C=O HF H2O 第四周期IVA族 作半导体 HClO4>H2SO4 Al(OH)3+OH-=AlO2-+2H2O ![]()
【解析】根据元素①~⑩在表中的位置可知它们分别是H、C、N、O、F、Na、Al、S、Cl、Ge。(1)元素③形成的单质是氮气,电子式为![]() ;元素②形成的最高价氧化物是二氧化碳,结构式为O=C=O;(2)非金属性越强,氢化物越稳定,②、③、④、⑤元素中F的非金属性最强,形成的氢化物HF热稳定性最强,水常温下是液态,沸点最高的是H2O;(3)Ge元素在周期表中的位置为第四周期IVA族;该元素的单质主要用途是作半导体;(4)氯元素非金属性强于硫元素,非金属性越强,最高价氧化物水化物的酸性越强,则⑧、⑨元素的最高价氧化物的水化物酸性强弱比较为HClO4>H2SO4;(5)⑥、⑦两元素的最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,它们之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(6)⑥、⑧两元素结合成化合物是离子化合物硫化钠,用电子式表示⑥、⑧两元素结合成化合物的形成过程为
;元素②形成的最高价氧化物是二氧化碳,结构式为O=C=O;(2)非金属性越强,氢化物越稳定,②、③、④、⑤元素中F的非金属性最强,形成的氢化物HF热稳定性最强,水常温下是液态,沸点最高的是H2O;(3)Ge元素在周期表中的位置为第四周期IVA族;该元素的单质主要用途是作半导体;(4)氯元素非金属性强于硫元素,非金属性越强,最高价氧化物水化物的酸性越强,则⑧、⑨元素的最高价氧化物的水化物酸性强弱比较为HClO4>H2SO4;(5)⑥、⑦两元素的最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,它们之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(6)⑥、⑧两元素结合成化合物是离子化合物硫化钠,用电子式表示⑥、⑧两元素结合成化合物的形成过程为![]() 。
。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案