题目内容
5.6.4g铜与过量硝酸(8mol/L,50mL)充分反应,硝酸的还原产物为NO和NO2,反应后溶液中含有H+ 0.05mol.(假定反应前后溶液体积不变),下列说法不正确的是( )| A. | NO与NO2的物质的量之比为1:5 | |
| B. | 反应后溶液中所含NO3-的物质的量浓度为0.5 mol/L | |
| C. | 被还原的硝酸的物质的量为0.15 mol | |
| D. | 上述过程转移电子总的物质的量为0.2 mol |
分析 A、铜元素失电子,被还原硝酸中的氮元素得电子,根据电子守恒和元素守恒来计算即可;
B、铜与过量硝酸反应,反应后溶液中的溶质是硝酸和硝酸铜,根据硝酸中NO3-和H+、硝酸铜中NO3-和Cu2+的关系式,由H+、Cu2+的量计算NO3-的物质的量,进而计算浓度;
C、被还原的硝酸的物质的量=总物质的量-剩余的硝酸-显示酸性的硝酸的物质的量;
D、根据电子守恒计算转移电子的物质的量.
解答 解:A、6.4gCu的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,Cu2+对应的NO3-为0.2mol,即为显示酸性的硝酸;H+对应的NO3-为0.05mol,即剩余的硝酸;被还原的硝酸的物质的量=总物质的量-剩余的硝酸-显示酸性的硝酸的物质的量=0.05L×8mol/L-0.05mol-0.2mol=0.15mol,设NO与NO2的物质的量分别是x、y,所有的铜失电子,共失电子是0.1mol×2=0.2mol,根据电子守恒:0.2=3x+y,根据N元素守恒,则x+y=0.15,联立两个方程,解得x=0.025mol,y=0.125mol,所以NO与NO2的物质的量之比为1:5,故A正确;
B、6.4gCu的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,Cu2+对应的NO3-为0.2mol,H+对应的NO3-为0.05mol,则此时溶液中含有NO3-的物质的量为0.25mol,反应后溶液中所含NO3-的物质的量浓度为$\frac{0.25mol}{0.05L}$=5mol/L,故B错误;
C、Cu2+对应的NO3-为0.2mol,即为显示酸性的硝酸;H+对应的NO3-为0.05mol,即剩余的硝酸;被还原的硝酸的物质的量=总物质的量-剩余的硝酸-显示酸性的硝酸的物质的量=0.05L×8mol/L-0.05mol-0.2mol=0.15mol,所以被还原的硝酸的物质的量为0.15 mol,故C正确;
D、6.4g铜与过量硝酸(8mol/L,50mL)充分反应,所有的铜失电子,共失电子是0.1mol×2=0.2mol,所以转移电子总的物质的量为0.2 mol,故D正确.
故选B.
点评 本题考查的是硝酸的性质及守恒法的运用,守恒有原子守恒、电荷守恒、质量守恒、得失电子守恒,在做题时要灵活运用,不能生搬硬套.

 阅读快车系列答案
阅读快车系列答案
| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
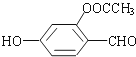 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )| A. | 2.5mol | B. | 3mol | C. | 3.5 mol | D. | 4 mol |
①澄清的石灰水 ②溴水 ③氯化钡溶液 ④品红溶液.
| A. | ①② | B. | ③④ | C. | ②④ | D. | 全部 |
| A. | 25℃时 NH4Cl 溶液的 KW 大于 100℃时 NaCl 溶液的 KW | |
| B. | SO2 通入碘水中,反应的离子方程式为 SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 加入铝粉能产生 H2 的溶液中,可能存在大量的 Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将 pH=2 的盐酸与 pH=12 的 NaOH 溶液等体积混合,溶液显中性 |
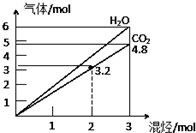 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )①可能有C2H2 ②一定有CH4 ③一定有C3H8 ④一定没有 C2H6 ⑤可能有C2H4.
| A. | ①②④ | B. | ②④⑤ | C. | ②③④ | D. | ②③ |
| A. | 萝卜风干 | B. | 苹果冷藏 | C. | 葡萄酿酒 | D. | 甘蔗榨汁 |
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 氧化还原反应的本质是电子的得失或偏移 | |
| C. | 臭氧与氧气结构不同,二者之间的转化是氧化还原反应 | |
| D. | Cl-、I-、S2-等只有还原性,但也有不少阴离子有较强的氧化性 |