题目内容
16.原子序数11-17的元素,自Na到Cl,电子层数相同,(1)最外层电子数从1增加到7,随着核电荷数依次递增;
(2)原子半径依次减小 (填“增大”或“减小”),核对外层电子的引力逐渐增大 (填“增强”或“减弱”,下同);
(3)失电子能力逐渐减弱,得电子能力逐渐增强,因此,金属性逐渐减弱,非金属性逐渐增强.
分析 (1)由Na到Cl,最外层电子数由1递增到7;
(2)同周期随原子序数增大,核电荷数对核外电子吸引增大,原子半径减小;
(3)同周期随原子序数增大,金属性减弱、非金属性增强,失电子能力减弱、得电子能力增强.
解答 解:(1)由Na到Cl,最外层电子数由1递增到7,故答案为:1;7;
(2)同周期随原子序数增大,原子半径依次减小,核电荷数对核外电子吸引逐渐增大,故答案为:减小;增大;
(3)同周期随原子序数增大,原子核对核外电子吸引增大,失电子能力减弱、得电子能力增强,金属性减弱、非金属性增强,故答案为:减弱、增强、减弱、增强.
点评 本题考查元素周期律,比较基础,注意从结构上理解同周期元素性质递变规律.

练习册系列答案
相关题目
7.某市大气质量监测站对市区出现雾霾时的大气监测发现:首先要污染物为PM2.5,并对其进行分析.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及浓度如下表:
根据表中数据计算该试样的pH=5.
(2)该地区若有降雨则可大大缓解雾霾天气,但也会带来另一种环境问题:形成酸雨.
(3)环境治理要从根源一着手,减少SO2、NO2等气体的排放是重要措施.汽车发动机工作时气缸中会引发N2和O2的反应,其能时变化示意图如下:
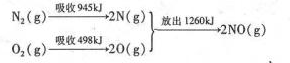
①写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
②汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:正反应为吸热反应,升高温度,平衡向着正向移动.
③将NO2变成无害的N2要找到合适的物质G与适当的反应条件,G应为还原剂(填“还原剂”或“氧化剂”).下式中X必须为无污染的物质,化学计量数n可为0.NO2+G→N2+H2O+nX(未配平的反应式)
下列化合物中满足上述反反应式式中的G是ad(填字母代号).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用电化学传感器能够准确、快速地测定NO2的含量.一种以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,则其负极的电极反应为NO+O2--2e-=NO2.若传感器检测的电子流量为1×10-3mol/s,则通过传感器的NO的流量为15mg/s.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及浓度如下表:
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
(2)该地区若有降雨则可大大缓解雾霾天气,但也会带来另一种环境问题:形成酸雨.
(3)环境治理要从根源一着手,减少SO2、NO2等气体的排放是重要措施.汽车发动机工作时气缸中会引发N2和O2的反应,其能时变化示意图如下:

①写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
②汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:正反应为吸热反应,升高温度,平衡向着正向移动.
③将NO2变成无害的N2要找到合适的物质G与适当的反应条件,G应为还原剂(填“还原剂”或“氧化剂”).下式中X必须为无污染的物质,化学计量数n可为0.NO2+G→N2+H2O+nX(未配平的反应式)
下列化合物中满足上述反反应式式中的G是ad(填字母代号).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用电化学传感器能够准确、快速地测定NO2的含量.一种以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,则其负极的电极反应为NO+O2--2e-=NO2.若传感器检测的电子流量为1×10-3mol/s,则通过传感器的NO的流量为15mg/s.
4.乙酸的某种同系物Q存在同类型的同分异构体下列,有关Q的说法中正确的是( )
| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
11.已知Na2SO4的化学式量为142,则500mL1.0mol•L-1 Na2SO4溶液含有溶质质量为( )
| A. | 35.5g | B. | 71g | C. | 119g | D. | 142g |
1.下列反应可制得纯净一氯乙烷的是( )
| A. | 乙烯通入浓盐酸中 | B. | 乙烯与氯化氢加成反应 | ||
| C. | 乙烷与氯气在光照下反应 | D. | 乙烷通入氯水中 |
5.6.4g铜与过量硝酸(8mol/L,50mL)充分反应,硝酸的还原产物为NO和NO2,反应后溶液中含有H+ 0.05mol.(假定反应前后溶液体积不变),下列说法不正确的是( )
| A. | NO与NO2的物质的量之比为1:5 | |
| B. | 反应后溶液中所含NO3-的物质的量浓度为0.5 mol/L | |
| C. | 被还原的硝酸的物质的量为0.15 mol | |
| D. | 上述过程转移电子总的物质的量为0.2 mol |
6.一包由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成.取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液X.在滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体.下列判断错误的是( )
| A. | 原白色粉末的组成有3组可能 | |
| B. | 原白色粉末中一定含有CaCO3 | |
| C. | 原白色粉末中一定不含有CuSO4 | |
| D. | 若向无色滤液X中通入二氧化碳,产生白色沉淀,则可推断原白色粉末中一定还含有BaCl2、NaOH |
 ,
, .
.