题目内容
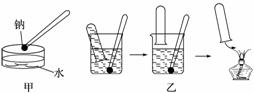
15.目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:2NaCl (熔融)═2Na+Cl2↑.现有如下转化关系:

(1)写出下列化学方程式:
A+H2O→C:2Na+2H2O═2NaOH+H2↑
C+D→NaCl:3NaOH+FeCl3═Fe(OH)3↓+3NaCl
E+F→NaCl:3NaOH+FeCl3═Fe(OH)3↓+3NaCl
(2)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用C物质溶液吸收,其化学方程式为Cl2+2NaOH═NaCl+NaClO+H2O.
(3)将A投入CuSO4的溶液中,观察到溶液中除了有气泡产生,甲同学认为还有红色铜生成,乙同学认为还有蓝色的Cu(OH)2生成.你支持乙同学的观点,理由是金属钠活泼,与水反应后生成NaOH,NaOH再与CuSO4反应生成蓝色的Cu(OH)2.
分析 氯化钠转化得到A、B,二者又得到NaCl,B与Fe反应生成D,则A为Na、B为Cl2,D为FeCl3,Na与水反应生成C,C与FeCl3反应生成NaCl,故C为NaOH,C与二氧化碳反应生成E,氯化铁与氢氧化钙反应生成F,E与F反应又生成NaCl,故E为Na2CO3、F为CaCl2,据此解答.
解答 解:氯化钠转化得到A、B,二者又得到NaCl,B与Fe反应生成D,则A为Na、B为Cl2,D为FeCl3,Na与水反应生成C,C与FeCl3反应生成NaCl,故C为NaOH,C与二氧化碳反应生成E,氯化铁与氢氧化钙反应生成F,E与F反应又生成NaCl,故E为Na2CO3、F为CaCl2,
(1)A+H2O→C反应的化学方程式为2Na+2H2O═2NaOH+H2↑,C+D→NaCl反应的化学方程式为3NaOH+FeCl3=3NaCl+Fe(OH)3↓,E+F→NaCl反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl,
故答案为:2Na+2H2O═2NaOH+H2↑;3NaOH+FeCl3=3NaCl+Fe(OH)3↓;Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)多余的氯气应用NaOH溶液吸收,其化学方程式为 Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(3)将Na投入CuSO4的溶液中,由于金属钠活泼,与水反应后生成NaOH,NaOH再与CuSO4反应生成蓝色的Cu(OH)2,所以观察到溶液中除了有气泡产生,还有蓝色的Cu(OH)2生成,所以乙同学的观点正确,
故答案为:乙;金属钠活泼,与水反应后生成NaOH,NaOH再与CuSO4反应生成蓝色的Cu(OH)2.
点评 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、氯气的性质是解答本题的关键,注意物质之间的转化即可解答,题目难度不大.

| A. | 20% | B. | 25% | C. | 74.4% | D. | 75% |
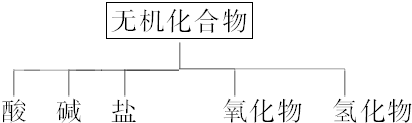
(1)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2S、HNO3、H2CO3、H2SO4 | ③NaOH、KOH ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2CO3、Na2SO4、K2CO3、K2SO4、NaNO3、KNO3 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(2)写出⑦转化为⑤的化学方程式:Na2O+CO2═Na2CO3.
(3)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$ 2H2O+O2↑,.
(4)实验室制备⑦常用石灰石(或大理石)和稀盐酸反应,检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是CO2.
| A. | 氢氧化钠溶液与稀硝酸反应:OH-+H+═H2O | |
| B. | 溴化钾溶液中通入氯气:Br-+Cl2═Br2+Cl- | |
| C. | 稀盐酸与碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| D. | 铁粉与稀硫酸反应:Fe+H+═Fe3++H2↑ |
5HClO2=4ClO2↑+H++Cl-+2H2O.向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
| A. | 在酸性条件下,亚氯酸钠的氧化性增强 | |
| B. | 溶液中的Cl-起催化作用 | |
| C. | ClO2逸出,使反应的生成物浓度降低 | |
| D. | 溶液中的H+起催化作用 |
 A的晶胞如图所示,已知A相对原子质量为M,晶体密度ρg•cm-3,阿伏伽德罗常数为NA,A元素的原子半径为$\root{3}{\frac{2M}{ρ×{N}_{A}}}$×$\frac{\sqrt{3}}{4}$cm.(用M、ρ、NA表示,不用化简)
A的晶胞如图所示,已知A相对原子质量为M,晶体密度ρg•cm-3,阿伏伽德罗常数为NA,A元素的原子半径为$\root{3}{\frac{2M}{ρ×{N}_{A}}}$×$\frac{\sqrt{3}}{4}$cm.(用M、ρ、NA表示,不用化简)