题目内容
5.双鸭山一中化学实验室最近迎来了第一批客人----高一化学兴趣小组.他们探究了如下实验:金属钠与饱和烧碱溶液的反应.该反应的演示方法分别如图甲、乙所示: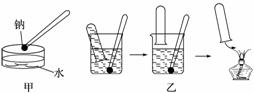
(1)现按图甲所示的方法,在室温时,向盛有饱和NaOH溶液的水槽中,加入一小块金属钠.下列有关描述正确的是ABD(填字母,下同)
a.钠浮在液面上,并四处游动,最后消失 b.钠熔化成一个光亮的小球
c.恢复到室温时,NaOH溶液的浓度增大 d.恢复到室温时,溶液中Na+数目减少
(2)反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中.取相同质量的钠按下列两种情况收集产生的气体在相同条件下体积的关系是b,
①用铝箔包住钠 ②用铜箔包住钠
a.二者收集气体一样多 b.①收集气体体积较大 c.②收集气体体积较大
选其的根据是2Al+2OH-+2H2O=2AlO2-+3H2↑(用离子方程式表示)
分析 (1)钠和水反应生成氢氧化钠和氢气,消耗水,饱和的氢氧化钠溶液中有NaOH晶体析出,温度不变,氢氧化钠的溶解度不变;
(2)钠与水反应生成氢氧化钠和氢气;
(3)生成的氢气包括钠和水反应的,氢氧化钠和其它金属能放出氢气则生成的氢气就较多;钠和水反应生成的氢气,氢氧化钠Al反应也能放出氢气,则生成的氢气就增多.
解答 解:(1)钠先和水反应,呈现的现象是:钠浮在水面上,熔化成一个光亮的小球,并四处游动,最后消失,消耗水,饱和的氢氧化钠溶液中有NaOH晶体析出,温度不变,氢氧化钠的溶解度不变,饱和溶液中溶剂减少,所以溶液中Na+数目减少,故答案为:ABD;
(2)钠与水反应生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)钠和水反应生成氢气和氢氧化钠,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以生成氢气体积最大的是用铝箔包住钠,故选b;钠和水反应生成的氢气,氢氧化钠Al反应也能放出氢气,则生成的氢气就增多,氢气增多的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:b;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题以钠的实验设计为载体考查了钠的性质,会根据钠的性质分析钠和水反应的实验现象即可解答,注意Al的化学性质,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
16.金属钠是体心立方堆积,关于钠晶体,下列判断合理的是( )
| A. | 其熔点比金属铝的熔点高 | |
| B. | 一个钠的晶胞中,平均含有4个钠原子 | |
| C. | 该晶体中的自由电子在外加电场作用下可发生定向移动 | |
| D. | 该晶体中的钠离子在外加电场作用下可发生定向移动 |
20.下列关于金属钠的叙述中,正确的是( )
| A. | 钠暗灰色固体 | |
| B. | 将金属钠在空气中加热则生成白色固体 | |
| C. | 钠投入到Fe2(SO4)3溶液中,钠先与H2O反应,钠投入到稀H2SO4中,钠也是先与H2O反应 | |
| D. | 钠可以制高压钠灯,是因为高压钠灯的灯光穿透能力强 |
10.下列溶液中Cl-物质的量浓度最大的是( )
| A. | 10 mL 0.1 mol•L-1的FeCl3溶液 | B. | 20 mL 0.1 mol•L-1的MgCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.45 mol•L-1的KClO3溶液 |
17.下列说法正确的是( )
| A. | 根据是否有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| B. | SO2和SiO2都是酸性氧化物,都能与水反应生成酸 | |
| C. | 漂白粉、水玻璃、氨水均为混合物 | |
| D. | Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
15.下列烷烃中,进行一氯取代反应后,只能生成三种沸点不同的有机物的是( )
| A. | (CH3)3CCH2CH2CH3 | B. | (CH3)2CHCH(CH3)2 | ||
| C. | (CH3CH2)2CH CH2CH3 | D. | (CH3)2CHCH2CH3 |

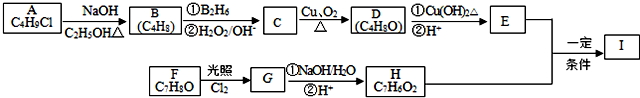
 ,生成I的反应类型取代反应;
,生成I的反应类型取代反应;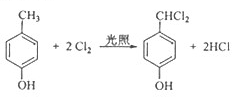 ;
;