题目内容
4.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸(HClO2为弱酸)不稳定可分解,反应的离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O.向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是( )
| A. | 在酸性条件下,亚氯酸钠的氧化性增强 | |
| B. | 溶液中的Cl-起催化作用 | |
| C. | ClO2逸出,使反应的生成物浓度降低 | |
| D. | 溶液中的H+起催化作用 |
分析 A.若酸使亚氯酸的氧化性增强,开始时反应速率应该就很快,而开始反应缓慢;
B.开始时溶液中氯离子浓度很小,随着反应进行,氯离子浓度逐渐增大;
C.ClO2逸出,反应正向移动;
D.开始时溶液中就有氢离子,反应速率很慢.
解答 解:A.若是酸使亚氯酸的氧化性增强,应该开始时反应速率应该就很快,与信息不符,故A错误;
B.反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,故B正确;
C.逸出的ClO2,反应正向移动,则反应的生成物的浓度增加,故C错误;
D.由于开始时溶液中就有氢离子,分解反应却非常慢,可见氢离子不起催化作用,故D错误;
故选B.
点评 本题以氯及其化合物的性质考查影响反应速率的因素,把握习题中的信息及知识迁移应用为解答的关键,侧重催化剂的考查,易错选项是B,题目难度不大.

练习册系列答案
相关题目
14.取少量苹果汁,加入碘水,溶液变蓝,则苹果中含有( )
| A. | 淀粉 | B. | 葡萄糖 | C. | 无机盐 | D. | 油脂 |
19.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | 0.1mol/LNaHSO4溶液中:K+、NH4+、HCO3-、NO3- | |
| B. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3COO- | |
| C. | 由水电离产生的C(H+)=10-13mol/L的溶液中:Na+、NO3-、SO42-、CO32- | |
| D. | NaNO3溶液中:Fe2+、H+、Cl-、I- |
16.金属钠是体心立方堆积,关于钠晶体,下列判断合理的是( )
| A. | 其熔点比金属铝的熔点高 | |
| B. | 一个钠的晶胞中,平均含有4个钠原子 | |
| C. | 该晶体中的自由电子在外加电场作用下可发生定向移动 | |
| D. | 该晶体中的钠离子在外加电场作用下可发生定向移动 |

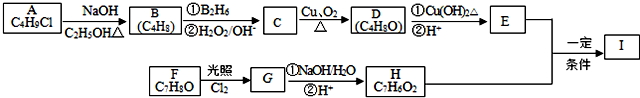
 ,生成I的反应类型取代反应;
,生成I的反应类型取代反应;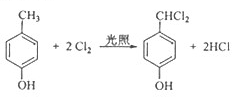 ;
;