题目内容
 A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在.将A、C的水溶液混合可得白色胶状沉淀B.
①A中含有的金属元素为
铝
铝
(填元素名称).②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,此反应的化学方程式为
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
(2)若A、B、C的焰色反应均呈黄色,水溶液均呈碱性.
①A中所含有的化学键是
离子键
离子键
、共价键
共价键
.②将4.48L(标准状况下)X通入100mL 3mol?L-1A的水溶液后,溶液中离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.③自然界中存在由B或C与H2O按一定比例结晶而成的固体.将一定量的由C与H2O按一定比例形成的晶体溶于水配制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol?L-1.若取相同质量的此晶体加热至恒重,剩余固体的质量为
2.65g
2.65g
.分析:A、B、C、X是中学化学常见物质,均由短周期元素组成.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,然后结合物质的性质及化学用语来解答.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠;
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳,然后结合物质的性质及化学用语来解答.
解答:解:A、B、C、X是中学化学常见物质,均由短周期元素组成,则
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,X为氢氧化钠,
①由上述分析可知A、B、C中含有的同一种常见金属元素为Al,名称为铝,故答案为:铝;
②Al与氧化铁发生铝热反应可用于焊接铁轨及定向爆破,此反应的化学方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,X为二氧化碳,
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是离子键、共价键,故答案为:离子键;共价键.
②X为二氧化碳,将4.48L(标准状况下)X通入100mL 3mol?L-1A的水溶液后,n(CO2)=0.2mol,n(NaOH)=0.3mol,反应的为3NaOH+2CO2=Na2CO3+NaHCO3+H2O,即反应后溶液中存在等量的Na2CO3、NaHCO3,溶液因水解显碱性,碳酸根离子水解大于碳酸氢根离子的水解,则溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>
c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为
×0.1L×0.5mol/L×106g/mol=2.65g.
故答案为:2.65g.
(1)若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,X为氢氧化钠,
①由上述分析可知A、B、C中含有的同一种常见金属元素为Al,名称为铝,故答案为:铝;
②Al与氧化铁发生铝热反应可用于焊接铁轨及定向爆破,此反应的化学方程式为2Al+Fe2O3
| ||
| ||
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,X为二氧化碳,
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,属于A中所含有的化学键是离子键、共价键,故答案为:离子键;共价键.
②X为二氧化碳,将4.48L(标准状况下)X通入100mL 3mol?L-1A的水溶液后,n(CO2)=0.2mol,n(NaOH)=0.3mol,反应的为3NaOH+2CO2=Na2CO3+NaHCO3+H2O,即反应后溶液中存在等量的Na2CO3、NaHCO3,溶液因水解显碱性,碳酸根离子水解大于碳酸氢根离子的水解,则溶液中离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>
c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为
| 1 |
| 2 |
故答案为:2.65g.
点评:本题考查无机物的推断,熟悉元素化合物知识是解答的前提,题目难度中等,注意B为白色沉淀及(2)中焰色为突破口,利用常见元素化合物的性质结合转化关系选择合适的物质进行解答即可.

练习册系列答案
相关题目
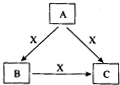 A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题: A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答: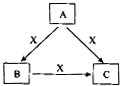 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题: A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题: