题目内容
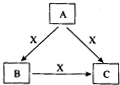 A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色沉淀.
①A、B、C中所含的金属元素为(写名称)
铝
铝
;A、C在水溶液中反应的离子方程式是Al3++3AlO2-+6H2O═4 Al(OH)3↓
Al3++3AlO2-+6H2O═4 Al(OH)3↓
.②等质量的该金属元素单质分别与足量盐酸、氢氧化钠溶液反应,生成氢气的体积之比(同温同压)是
1:1
1:1
,消耗盐酸、氢氧化钠物质的量之比是3:1
3:1
.(2)若A为具有防火、阻燃性物质的稀溶液,X是具有漂白性的无色气体,A转化为B的同时还得到另一种带负电荷的胶体,则B是
Na2SO3
Na2SO3
,A转化为C的离子方程式是SiO32-+2SO2+2H2O═H2SiO3(胶体)+2HSO3-
SiO32-+2SO2+2H2O═H2SiO3(胶体)+2HSO3-
.X可使溴水褪色,其反应的离子方程式是Br2+SO2+2H2O═4H++2Br-+SO42-
Br2+SO2+2H2O═4H++2Br-+SO42-
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性,x是一种温室气体,且A是一种常见强碱.
①工业上生产C的化学反应方程式是
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
.②工业上由C得到B的化学反应方程式为
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
③自然界中由B、C和H2O按一定比例结晶而成的固体W.取一定量W溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L.若取相同质量的W加热至恒重,剩余固体的质量为
2.65g
2.65g
.分析:(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色沉淀,由转化关系可知,A含有铝离子,B为 Al(OH)3,C含有偏铝酸根,x为NaOH;
(2)X是具有漂白性的无色气体,则X是SO2,若A为具有防火、阻燃性物质的稀溶液,则A是Na2SiO3,硅酸钠和二氧化硫、水反应生成生成亚硫酸钠和硅酸,硅酸胶体能吸附带负电荷的离子,注意硅酸胶粒带负电,所以B是Na2SO3,Na2SO3和SO2、水反应生成NaHSO3,所以C是NaHSO3;
(3)A、B、C的焰色反应均呈黄色,说明都含有钠元素,水溶液均为碱性,x是一种温室气体,则x是CO2,且A是一种常见强碱且含有钠元素,则A是NaOH,NaOH和少量CO2反应生成Na2CO3,所以B是Na2CO3,NaOH和过量二氧化碳反应生成NaHCO3,则C是NaHCO3.
(2)X是具有漂白性的无色气体,则X是SO2,若A为具有防火、阻燃性物质的稀溶液,则A是Na2SiO3,硅酸钠和二氧化硫、水反应生成生成亚硫酸钠和硅酸,硅酸胶体能吸附带负电荷的离子,注意硅酸胶粒带负电,所以B是Na2SO3,Na2SO3和SO2、水反应生成NaHSO3,所以C是NaHSO3;
(3)A、B、C的焰色反应均呈黄色,说明都含有钠元素,水溶液均为碱性,x是一种温室气体,则x是CO2,且A是一种常见强碱且含有钠元素,则A是NaOH,NaOH和少量CO2反应生成Na2CO3,所以B是Na2CO3,NaOH和过量二氧化碳反应生成NaHCO3,则C是NaHCO3.
解答:解:(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色沉淀,由转化关系可知,A含有铝离子,B为 Al(OH)3,C含有偏铝酸根,x为NaOH,
①通过以上分析知,A、B、C中所含的金属元素为铝,A中含有铝离子,C中含有偏铝酸根离子,二者反应生成氢氧化铝程度,离子反应方程式为:Al3++3AlO2-+6H2O═4 Al(OH)3↓,
故答案为:铝;Al3++3AlO2-+6H2O═4 Al(OH)3↓;
②等质量的铝和盐酸、氢氧化钠溶液反应方程式分别为:2Al+6HCl=2AlCl3+3H2↑、2NaOH+2Al+2H2O=2NaAlO2+3H2↑,铝的质量相等,则生成氢气的体积在相同条件下相等;
根据方程式知,等质量的铝需要盐酸和氢氧化钠的物质的量之比为6:2=3:1,
故答案为:1:1;3:1;
(2)X是具有漂白性的无色气体,则X是SO2,若A为具有防火、阻燃性物质的稀溶液,则A是Na2SiO3,硅酸钠和二氧化硫、水反应生成生成亚硫酸钠和硅酸,硅酸胶体能吸附带负电荷的离子,注意硅酸胶粒带负电,所以B是Na2SO3,Na2SO3和SO2、水反应生成NaHSO3,所以C是NaHSO3;
通过以上分析知,B是Na2SO3,硅酸钠和过量二氧化硫、水反应生成亚硫酸氢钠和硅酸,离子反应方程式为:
SiO32-+2SO2+2H2O═H2SiO3(胶体)+2HSO3-,二氧化硫具有还原性,溴具有强氧化性,在水溶液里,溴能将二氧化硫氧化生成硫酸,离子反应方程式为Br2+SO2+2H2O═4H++2Br-+SO42-,
故答案为:Na2SO3;SiO32-+2SO2+2H2O═H2SiO3(胶体)+2HSO3-;Br2+SO2+2H2O═4H++2Br-+SO42-;
(3)A、B、C的焰色反应均呈黄色,说明都含有钠元素,水溶液均为碱性,x是一种温室气体,则x是CO2,且A是一种常见强碱且含有钠元素,则A是NaOH,NaOH和少量CO2反应生成Na2CO3,所以B是Na2CO3,NaOH和过量二氧化碳反应生成NaHCO3,则C是NaHCO3,
①C是碳酸氢钠,工业上用氨碱法制取碳酸氢钠,反应方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
②工业上用加热碳酸氢钠的方法制取碳酸钠,在加热条件下,碳酸氢钠分解生成碳酸钠和水二氧化碳,反应方程式为:2NaHCO3
Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,m(Na2CO3)=
×0.1L×0.5mol/L×106g/mol=2.65g,
故答案为:2.65g.
①通过以上分析知,A、B、C中所含的金属元素为铝,A中含有铝离子,C中含有偏铝酸根离子,二者反应生成氢氧化铝程度,离子反应方程式为:Al3++3AlO2-+6H2O═4 Al(OH)3↓,
故答案为:铝;Al3++3AlO2-+6H2O═4 Al(OH)3↓;
②等质量的铝和盐酸、氢氧化钠溶液反应方程式分别为:2Al+6HCl=2AlCl3+3H2↑、2NaOH+2Al+2H2O=2NaAlO2+3H2↑,铝的质量相等,则生成氢气的体积在相同条件下相等;
根据方程式知,等质量的铝需要盐酸和氢氧化钠的物质的量之比为6:2=3:1,
故答案为:1:1;3:1;
(2)X是具有漂白性的无色气体,则X是SO2,若A为具有防火、阻燃性物质的稀溶液,则A是Na2SiO3,硅酸钠和二氧化硫、水反应生成生成亚硫酸钠和硅酸,硅酸胶体能吸附带负电荷的离子,注意硅酸胶粒带负电,所以B是Na2SO3,Na2SO3和SO2、水反应生成NaHSO3,所以C是NaHSO3;
通过以上分析知,B是Na2SO3,硅酸钠和过量二氧化硫、水反应生成亚硫酸氢钠和硅酸,离子反应方程式为:
SiO32-+2SO2+2H2O═H2SiO3(胶体)+2HSO3-,二氧化硫具有还原性,溴具有强氧化性,在水溶液里,溴能将二氧化硫氧化生成硫酸,离子反应方程式为Br2+SO2+2H2O═4H++2Br-+SO42-,
故答案为:Na2SO3;SiO32-+2SO2+2H2O═H2SiO3(胶体)+2HSO3-;Br2+SO2+2H2O═4H++2Br-+SO42-;
(3)A、B、C的焰色反应均呈黄色,说明都含有钠元素,水溶液均为碱性,x是一种温室气体,则x是CO2,且A是一种常见强碱且含有钠元素,则A是NaOH,NaOH和少量CO2反应生成Na2CO3,所以B是Na2CO3,NaOH和过量二氧化碳反应生成NaHCO3,则C是NaHCO3,
①C是碳酸氢钠,工业上用氨碱法制取碳酸氢钠,反应方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
②工业上用加热碳酸氢钠的方法制取碳酸钠,在加热条件下,碳酸氢钠分解生成碳酸钠和水二氧化碳,反应方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,m(Na2CO3)=
| 1 |
| 2 |
故答案为:2.65g.
点评:本题考查了铝、硫、钠元素化合物的推断,涉及离子方程式的书写、物质的工业制取等知识点,明确物质的性质是解本题关键,(3)③结合原子守恒来进行计算,二氧化硫能使溴水褪色是利用了二氧化硫的还原性而不是漂白性,为易错点.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答: A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
 A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去).请回答下列问题: A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题:
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去).请回答下列问题: