��Ŀ����
����Ŀ��ij�л�����C��H��O����Ԫ����ɣ������к���8��ԭ�ӣ�1mol���л��ﺬ��46mol���ӣ���ȫȼ�ո��л�������ͬ�����²ⶨCO2��ˮ���������Ϊ2��1��ȡ2.7g���л���ǡ����30mL 1mol/L��̼������Һ��ȫ��Ӧ������д����Ҫ�ļ�����̣���
��1���л������ʽ��
��2���л���ṹ��ʽ��
��3��д�����л�����һ�����������Ҷ�����Ӧ������Ԫ��״������ķ���ʽ��
���𰸡�
��1���⣺����CO2��ˮ���������Ϊ2��1�ã�N��C����N��H��=1��1��
������л���ķ���ʽΪCxHxOy��x��1��y��1��2x+y=8����
��x=1��y=6��������������46�����������⣬
��x=2��y=4����������=6��2+1��2+8��4=46���������⣮
������л���ķ���ʽΪC2H2O4��
���л������ʽΪC2H2O4��
��2���⣺���л������Է�������Ϊ90��
2.7g���л�������ʵ���Ϊ0.03mol��̼���Ƶ����ʵ���Ϊ0.03mol��
����л��ﺬ�����Ȼ����ṹ��ʽHOOC��COOH��
���л���Ľṹ��ʽΪ��HOOC��COOH��
��3���⣺���л�����һ�����������Ҷ�����Ӧ������Ԫ��״������ķ���ʽΪHOOC��COOH+HOH2C��CH2OH ![]()
 +2H2O��
+2H2O��
������������ͬ�����²�ò���CO2�����ˮ�����������Ϊ2��1���л���A��̼ԭ������ԭ�����ʵ�����Ϊ2��1��2=1��1�� 2.7g���л���ǡ����30mL 1mol/L��̼������Һ��ȫ��Ӧ������л����к����Ȼ�������2��COOH��Na2CO3��ϵʽ��֪���Ȼ������ʵ����͵���̼�����Ƶ����ʵ�����2����Ȼ�����۳�A��Ħ����������д�ɷ���ʽ�ͽṹ��ʽ���Դ˽����⣮

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ������У���Ϊ������������Ϊ��ѹ�������������з�Ӧ��N2��g��+3H2��g��2NH3��g����H2=��92.4kJ/mol���й����ݼ��ض�ƽ��״̬������
���� | ��ʼͶ�� | ��ƽ��ʱ | |||
�� | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
�� | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
��1����ƽ���ͬ�����ʵ����������ͬ����ʼʱ������ͨ���N2�����ʵ���Ϊ ��
��ʼʱ���е�ѹǿ�Ǽ������������ҵ�ƽ�ⳣ��Ϊ
��2�������ܱ������п��Է��������ķֽⷴӦ����ƽ����ı��±��з�Ӧ����x�����и�����y��x����������������ѡ����ţ���
ѡ�� | a | b | c | d |
x | �¶� | �¶� | ����H2�����ʵ��� | ���백�������ʵ��� |
y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ������ת���� |
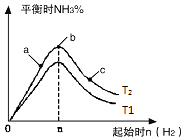
��3���о���������������ʱ���ı���ʼ�����������ʵ����Է�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
������T2��T1�Ĺ�ϵ�ǣ�T2T1������ڡ������ڡ������ڡ�����ȷ��������
��a��b��c�����У�N2ת������ߵ���������ĸ����
���������ݻ�Ϊ1L��T2������ʼ��ϵ�м���1mol N2 �� 3molH2 �� ����5min��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����NH3�ķ�Ӧ����Ϊ �� ��������������䣬����ʼʱ�������ڷ���2mol N2��6mol H2 �� ��ƽ���ų�������ΪQ����Q110.88kJ�����������������=������