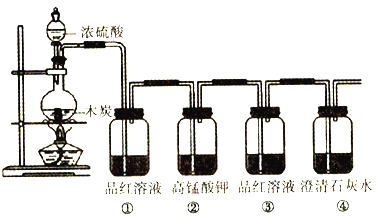
题目内容
【题目】根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2O![]() Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+离子的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
A. X>Y>Z>W B. Y>X>W>Z
C. Z>X>Y>W D. Z>Y>X>W
【答案】C
【解析】试题分析:)X+Y2+===X2++Y ,说明X比Y的还原性强,Z+2H2O![]() Z(OH)2+H2↑,说明了Z的还原性比水强,Z2+的氧化性比X2+弱,说明Z的还原性比X强,由Y、W作电极组成的原电池反应为:Y-2e-===Y2+,说明Y的还原性比W强,所以X、Y、Z、W的还原性由强到弱的顺序是Z>X>Y>W,答案为C。
Z(OH)2+H2↑,说明了Z的还原性比水强,Z2+的氧化性比X2+弱,说明Z的还原性比X强,由Y、W作电极组成的原电池反应为:Y-2e-===Y2+,说明Y的还原性比W强,所以X、Y、Z、W的还原性由强到弱的顺序是Z>X>Y>W,答案为C。

【题目】U,W,Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | |||
W | Y |
(1)元素U的原子核外共有种不同能级的电子.
(2)能提高W与稀硫酸反应速率的方法是
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g) ![]() 2YO3(g)△H2=﹣190kJ/mol
2YO3(g)△H2=﹣190kJ/mol
①该反应 450℃时的平衡常数500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2 , 半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=:平衡常数为 . 若继续通入0.20molYO2和0.10molO2 , 再次达到平衡后,YO3物质的量约为 .