题目内容
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
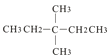
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
【答案】 3d ![]() A中含氢键 ABC sp2 1:1 4
A中含氢键 ABC sp2 1:1 4 ![]() 或
或 ![]()
【解析】(1)镍的原子序数为28,其电子排布式为1S22S22P63S23P64S23d8,其价电子的轨道表达式为![]() ,所以基态镍原子核外电子填充的能量最高的能级符号为3d;
,所以基态镍原子核外电子填充的能量最高的能级符号为3d;
(2)A中有O—H键,而B中没有,而有O—H键的物质可在分子间形成氢键,使物质的熔沸点升高;在A的分子结构中有C=N双键,其中有σ键和π键,有箭头所示的配位键,故选ABC,其中的N原子以sp2方式杂化;
(3)某缺陷砷化镍的组成为Ni1.2As, 其中Ni元素只有+2和+3两种价态,设+2价的Ni为x个,+3价的Ni为y个,则由原子守恒得x+y=1.2,由化合价原则得2x+3y=3,求出x=y=0.6,所以两种价态的镍离子数目之比为1:1;
(4) 由NiAs的晶胞结构分析可知,与一个Ni3+距离最近的等径As3-为2×2=4个,所以镍离子的配位数为4;该晶胞中含有的Ni3+为(1/8)×8+(1/2)×6=4,含有的As3-为4,即含有4个NiAs微粒,设其棱长为acm,其质量为(134×4)/ NA g,所以a=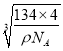 cm,而As3-位于其1/8晶胞的体心,两个As3-间的距离相当于面对角线的一半,即
cm,而As3-位于其1/8晶胞的体心,两个As3-间的距离相当于面对角线的一半,即![]() a=
a=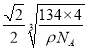 ×1010pm。
×1010pm。