题目内容
【题目】在0.25 mol Na2SO4中,含有的氧原子个数约为
A.1B.0.25
C.6.02×1023D.3.01×1023
【答案】C
【解析】
每个Na2SO4中有4个氧原子,故在0.25 mol Na2SO4中共有1mol氧原子,为NA个,答案选C。

练习册系列答案
相关题目
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
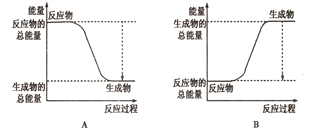
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时![]() (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
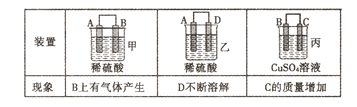
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。