题目内容
20.共价键、离子键、分子间作用力都是微粒间的作用力,含有以上两种作用力的物质是( )| A. | SiO2 | B. | Ar | C. | NaOH | D. | CO |
分析 一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键,离子晶体中含有离子键,以共价键结合的物质可能为原子晶体,也可能为分子晶体,在分子晶体中还存在分子间作用力,以此来解答.
解答 解:A.SiO2中只有共价键,为原子晶体,故A不选;
B.Ar是稀有气体,是由原子构成的単原子分子,分子中无化学键,分子间存在分子间作用力,故B错误;
C.NaOH为离子化合物,含有离子键和共价键,故C选;
D.CO为共价化合物,C与O间形成共价键,分子间存在分子间作用力,所以含有两种作用力,故D选.
故选CD.
点评 本题考查化学键和晶体,注意化学键的形成规律及分子晶体中存在分子间作用力即可解答,注意分子中存在分子间作用力是学生解答的难点,难度不大.

练习册系列答案
相关题目
10.CH3OH和C2H5OH的混合物与浓H2SO4共热,可能生成的有机物最多有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
11.X、Y、Z是短周期元素,已知X元素的原子核内无中子,Y元素的最高正价与负价代数和为2,Z元素原子的最外层达到相对稳定结构所需电子数恰好等于其内层电子数,则X、Y、Z三种元素所形成化合物的化学式表示错误的是( )
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ3 | D. | X3YZ4 |
8.对于溶液中某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ | |
| D. | 加入氨水直至氨水过量,先产生白色沉淀,后沉淀消失,一定有Al3+ |
15.在1mol/L的(NH4)2SO4溶液中,下列有关离子浓度大小比较中,正确的是( )
| A. | c(NH4+)=2c(SO42-)>c(H+)=c(OH-) | B. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | ||
| C. | c(SO42-)>c(NH4+)>c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
5.下列各组微粒中,都互为等电子体的是( )
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3-、CNO- | ||
| C. | CO32-、NO3-、BeCl2 | D. | SiF4、SiO44-、SO42-、PO43- |
12.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | 核外电子总数相同的原子,一定是同种元素的原子 | |
| D. | 化合反应和置换反应均属于氧化还原反应 |
9. 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
12.水煤气法制甲醇工艺流程框图如下:
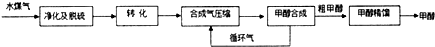
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+$\frac{3}{2}$O2 (g)?CO(g)+2H2O (g)△H=-519KJ•mol-1.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ•mol-1.T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•(L•min)-1.
(3)生产过程中,合成气要进行循环,其目的是提高原料CO、H2的利用率(或提高产量、产率亦可);.
(4)下图1为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.

E为该燃料电池的负极极(填“正”或“负”).F电极上的电极反应式为ClO-+2e-+H2O═Cl-+2OH-.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①在N电极上乙二酸生成乙醛酸的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
②若有2molH+通过质子交换膜完全参与反应,则生成的乙醛酸为2mol.

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+$\frac{3}{2}$O2 (g)?CO(g)+2H2O (g)△H=-519KJ•mol-1.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ•mol-1.T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•(L•min)-1.
(3)生产过程中,合成气要进行循环,其目的是提高原料CO、H2的利用率(或提高产量、产率亦可);.
(4)下图1为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.

E为该燃料电池的负极极(填“正”或“负”).F电极上的电极反应式为ClO-+2e-+H2O═Cl-+2OH-.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①在N电极上乙二酸生成乙醛酸的电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O.
②若有2molH+通过质子交换膜完全参与反应,则生成的乙醛酸为2mol.