题目内容
8.图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系.(反应中生成的水已略去)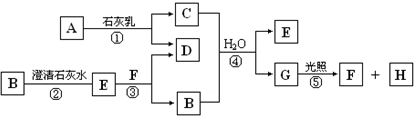
请回答以下问题:
(1)E是CaCO3,H是O2.(填化学式)
(2)C物质在日常生活中的用途,可用作消毒(或漂白)剂.
(3)写出反应①的化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(4)写出反应④的化学方程式:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO.
分析 中学常见能与氢氧化钙反应的气体有氯气、二氧化碳、二氧化硫等,B、C反应得到G在光照条件下反应生成气体H,应是HClO分解生成HCl与O2,则G为HClO,F为HCl,H为O2,B与澄清石灰水反应得到E,E与F反应又得到B,由于次氯酸盐具有强氧化性,则B为CO2,E为CaCO3,结合转化可推知A为Cl2,C为Ca(ClO)2,D为CaCl2.
解答 解:中学常见能与氢氧化钙反应的气体有氯气、二氧化碳、二氧化硫等,B、C反应得到G在光照条件下反应生成气体H,应是HClO分解生成HCl与O2,则G为HClO,F为HCl,H为O2,B与澄清石灰水反应得到E,E与F反应又得到B,由于次氯酸盐具有强氧化性,则B为CO2,E为CaCO3,结合转化可推知A为Cl2,C为Ca(ClO)2,D为CaCl2.
(1)由以上分析可知,E为CaCO3,H为O2,
故答案为:CaCO3;O2;
(2)C为Ca(ClO)2,可生成HClO,具有强氧化性和漂白性,可用于消毒或漂白,
故答案为:消毒(或漂白);
(3)反应①的化学方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)反应④的化学方程式为:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO.
点评 本题考查无机物的推断,基本属于猜测验证型,根据能与氢氧化钙反应的气体为突破口,需要学生熟练掌握元素化合物知识,题目难度中等.

练习册系列答案
相关题目
19.在进行中和反应的反应热测定的实验中不需要用到的仪器是( )
| A. | 天平 | B. | 温度计 | C. | 环形玻璃搅拌棒 | D. | 量筒 |
16.下列叙述中正确的是( )
| A. | 能电离出H+的化合物都是酸 | |
| B. | 胶体区别于其他分散系的本质特征是能产生丁达尔效应 | |
| C. | 冰水混合物是电解质 | |
| D. | 强电解质溶液的导电能力一定强 |
13.对于化学反应方向的确定,下列说法正确的( )
| A. | 反应的焓变是决定反应能否自发进行的唯一因素 | |
| B. | 温度、压强一定时,放热反应能自发进行 | |
| C. | 固体的溶解过程与焓变无关 | |
| D. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
18.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产 物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 氧化性由强到弱顺序为MnO4->C12>Fe3+>Br2 | |
| B. | 第①组反应的氧化产物为O2 | |
| C. | 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
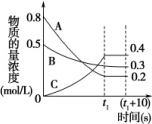 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则 2C
2C 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题. .画出G离子的结构示意图
.画出G离子的结构示意图