题目内容
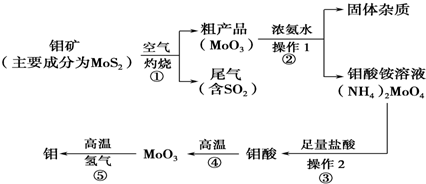
18. 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则(1)该反应的化学方程式为:3A+B
 2C
2C(2)t1 s时反应物A的转化率为:75%
(3)0~t1 s内A的反应速率为v(A)=$\frac{0.6}{{t}_{1}}$mol/(L.s).
分析 (1)由图象可知,在反应中,A、B的浓度逐渐减小,C的浓度逐渐增大,则A、B为反应物,C为生成物,t1 s时A、B浓度不变且不为0,说明是可逆反应,化学反应中浓度变化之比等于化学计量数之比,进而书写反应方程式;
(2)t1 s时反应物A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,A的转化率=$\frac{A的浓度变化量}{A的起始浓度}$×100%;
(3)0~t1 s内A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,根据v=$\frac{△c}{△t}$计算v(A).
解答 解:(1)由图象可知,在反应中,A、B的浓度逐渐减小,C的浓度逐渐增大,则A、B为反应物,C为生成物,t1 s时A、B浓度不变且不为0,说明是可逆反应,t1 s内△c(A):△c(B):△c(C)=(0.8-0.2):(0.5-0.3):0.4=3:1:2,化学反应中浓度变化之比等于化学计量数之比,则化学方程式为3A+B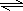 2C,
2C,
故答案为:3A+B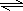 2C;
2C;
(2)t1 s时反应物A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,A的转化率=$\frac{0.6mol/L}{0.8mol/L}$×100%=75%,故答案为:75%;
(3)0~t1s内A的浓度变化量为(0.8-0.2)mol/L=0.6mol/L,则v(A)=$\frac{0.6mol/L}{{t}_{1}s}$=$\frac{0.6}{{t}_{1}}$mol/(L.s),故答案为:$\frac{0.6}{{t}_{1}}$mol/(L.s).
点评 本题考查化学平衡有关计算、反应速率计算、化学平衡图象,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
8.除去Cl2中混有的少量HCl气体,可将气体通入( )
| A. | 苛性钠溶液 | B. | 饱和NaHCO3溶液 | C. | 澄清石灰水 | D. | 饱和氯化钠溶液 |
9.下列有关热化学方程式的叙述正确的是( )
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0.则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol.则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol.则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol.则该反应的中和热为114.6 kJ/mol |
10.下列说法中正确的是( )
| A. | BC胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热,以制取Fe(OH)3胶体 | |
| C. | Fe(OH)3胶体粒子在电场影响下将向阴极运动,说明Fe(OH)3胶体带正电 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加时,沉淀又会消失 |
 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注. 甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下: