题目内容
20.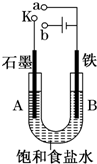 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.(1)若开始时开关K与a连接,则A极的电极反应式为O2+2H2O+4e-=4OH-.
(2)若开始时开关K与b连接,则A极的电极反应式为2Cl--2e-=Cl2↑,
总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
分析 (1)若开始时开关K与a连接,则形成原电池反应,为铁的吸氧腐蚀;
(2)若开始时开关K与b连接,形成电解池装置,石墨为阳极,发生氧化反应生成氯气,铁为阴极,发生还原反应生成氢气和氢氧化钠,以此解答.
解答 解:(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe-2e-=Fe2+,A极上氧气得电子被还原,电极方程式为O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电极方程式为2H++2e-=H2↑,A是阳极,发生失电子的氧化反应,电极反应式为:2Cl--2e-=Cl2↑,电解氯化钠溶液的总反应是:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
故答案为:2Cl--2e-=Cl2↑;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题综合原电池和电解质知识,侧重于学生的分析能力和电化学知识的综合应用,注意解题时要注意分析电极反应及生成物,难度中等.

练习册系列答案
相关题目
10.下列说法中正确的是( )
| A. | BC胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色沉淀,停止加热,以制取Fe(OH)3胶体 | |
| C. | Fe(OH)3胶体粒子在电场影响下将向阴极运动,说明Fe(OH)3胶体带正电 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加时,沉淀又会消失 |
11.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,1 mol 氦气含有的原子数为NA | |
| C. | 常温常压下,22.4L氯气与足量金属钠充分反应,转移的电子数为2NA | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
15.下列说法正确的是( )
| A. | 一定条件下,增大反应物的量会加快化学反应速率 | |
| B. | 增大压强,肯定会加快化学反应速率 | |
| C. | 构成物质微粒间的化学键键能越小,该物质的能量就越低,物质越稳定 | |
| D. | 升高温度能使单位体积内的活化分子数增加,从而增大化学反应速率 |
5.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 任何条件下,等物质的量的N2和CO所含的分子数必相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 铁的摩尔质量在数值上等于铁原子的相对原子质量 |
12.下列有关实验操作或仪器的使用正确的是( )
| A. |  分液时取出下层液体 | B. | 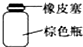 存放浓硝酸 | ||
| C. |  收集NO气体 | D. |  吸收尾气中的SO2 |
9.下列化学用语表示的含义不相同的是( )
| A. | CH3CH3,C2H6 | B. | -NO2,NO2 | C. |  ,OH- ,OH- | D. | 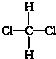 , ,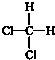 |
10.能正确表示下列反应的离子方程式是( )
| A. | 向NaHS溶液中通入适量氯气:HS-+C12═S↓+H++2Cl- | |
| B. | FeCl3溶液中滴加KI溶液:2Fe3++6I-═2Fe↓+3I2 | |
| C. | 碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-═CaCO3+CO32-+2H2O | |
| D. | 将SO2气体通入Ba(NO3)2溶液:SO2+H2O+Ba2+═BaSO3↓+2H+ |