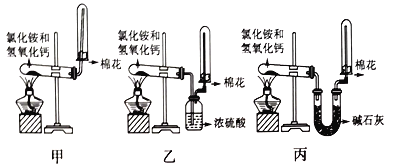
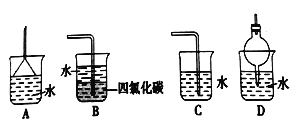
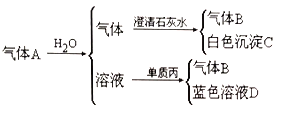
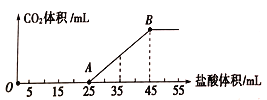
��Ŀ����
����Ŀ��Na��Cu��Fe��Cl��O��N�dz�����6��Ԫ�أ�
��1��Feλ��Ԫ�����ڱ������ڵ��壻O�Ļ�̬ԭ�Ӻ�������δ�ɶԵ��ӣ�Cu�Ļ�̬ԭ�ӵ����Ų�ʽΪ ��
��2���á�����������գ�
��һ������ | ԭ�Ӱ뾶 | �ȶ��� |
NO | CNa | NH3H2O |
��3��Һ̬N2H4��Һ̬N2O4��Ӧ������̬ˮ����25�桢101kPa�£���֪�÷�Ӧÿ����1mol N2H4�ų�519.85kJ���������÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ�ǣ�
��4�����ϵĵ����������õ��Ʊ�N2H4�ķ�����NaClO��Һ����������NH3 �� д���÷�Ӧ�����ӷ���ʽ�����������ת�Ƶķ������Ŀ ��
���𰸡�
��1���ģ�����2��1s22s22p63s23p63d104s1
��2������������
��3��N2O4��l��+2N2H4��l��=3N2��g��+4H2O��g����H=1038.7kJ/mol
��4��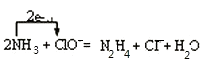
���������⣺��1��Fe����26��Ԫ�أ�λ��Ԫ�����ڱ��������ڵڢ����壻Oԭ�Ӻ�������Ų�ʽΪ1s22s22p4 �� δ�ɶԵ�����2����Cu�Ļ�̬ԭ�ӵ����Ų�ʽΪ1s22s22p63s23p63d104s1 �� ���Դ��ǣ��ģ�����2��1s22s22p63s23p63d104s1����2��ͬ����Ԫ���������ҵ�һ������������N��2P�����ǰ����״̬����һ�����ܱ��ͬ����Ԫ����������ԭ�Ӱ뾶��С���ǽ�����Խǿ���⻯���ȶ���Խǿ��O�ķǽ����Դ���N�ģ����Դ��ǣ���������������3����25�桢101kPa�£���֪�÷�Ӧÿ����1mol N2H4�ų�519.85kJ���������÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ��N2O4��l��+2N2H4��l��=3N2��g��+4H2O��g����H=1038.7kJ/mol�����Դ��ǣ�N2O4��l��+2N2H4��l��=3N2��g��+4H2O��g����H=1038.7kJ/mol����4��NaClO��Һ����������NH3����N2H4 �� �÷�Ӧ�а�ʧ���ӣ�Cl�õ��ӣ����ӷ���ʽΪ 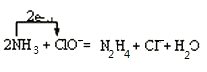 �����Դ��ǣ�
�����Դ��ǣ� 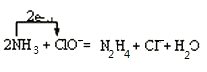 ��
��

 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�