题目内容
下列表述不正确的是
| A.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| B.铝热反应会放出大量的热,因此常温下就能顺利发生 |
| C.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大 |
D.对于化学反应COCl2(g) CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 |
B
解析试题分析:A、化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以对于一个确定的反应来说,平衡常数的数值越大,反应限度越大,A正确;B、反应条件与反应是放热反应还是吸热反应无关,铝热反应会放出大量的热,但反应需要在高温下才能发生,B不正确;C、碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,而该反应是吸热反应,所以根据△G=△H-T·△S可知,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大,C正确;D、可逆反应COCl2(g) CO(g)+Cl2(g)是体积增大的放热的,因此当反应达平衡时,恒温恒压条件下通入Ar,由于容器的容积必须增大,则相当于是降低压强,所以平衡向正反应方向移动,能提高COCl2的转化率,D正确,答案选B。
CO(g)+Cl2(g)是体积增大的放热的,因此当反应达平衡时,恒温恒压条件下通入Ar,由于容器的容积必须增大,则相当于是降低压强,所以平衡向正反应方向移动,能提高COCl2的转化率,D正确,答案选B。
考点:考查反应自发性、反应热以及外界条件对平衡状态的影响

下列说法中不正确的是
| A.开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
| B.钢铁是用量最大、用途最广泛的合金 |
| C.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| D.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 |
反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为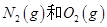 反应生成
反应生成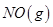 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是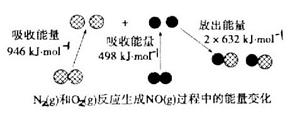
A.通常情况下,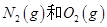 混合能直接生成NO 混合能直接生成NO |
B.1mol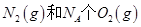 反应放出的能量为180kJ 反应放出的能量为180kJ |
| C.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
D.1mol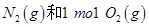 具有的总能量小于2mol 具有的总能量小于2mol 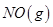 具有的总能量 具有的总能量 |
有关能量的判断或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| B.从C(石墨)==C(金刚石) ΔH=+1.19 kJ·mol-1,可知:金刚石比石墨更稳定 |
| C.由H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1,可知:含0.5 mol H2SO4的浓溶液与含1 molNaOH的溶液混合,放出热量大于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1 |
下列说法中正确的是
| A.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照条件下和点燃条件下的ΔH不同 |
| B.常温下,2A(s)+B(g)= 2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 |
| C.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热 |
| D.在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
节能减排成为社会发展过程中不可回避的问题。下列说法正确的是
①推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量。
②乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点之一。
③乙醇属于可再生资源,使用乙醇汽油可以缓解目前石油紧缺的矛盾。
④太阳能、风能、水能、生物质能、地热能和海洋能等都属于可再生能源。
⑤乙醇属于一级能源
| A.①②⑤ | B.①②③ | C.③④ | D.①②③④ |
未来新能源的特点是资源丰富,使用时污染很小,可再生。下列符合未来新能源标准的是:①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
| A.①②③④ | B.④⑤⑥⑦ | C.③⑤⑥⑦ | D.③④⑤⑥⑦ |
下列有关热化学方程式的叙述,正确的是
| A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
B.由N2O 4(g)  2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ |
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选) ( )。
C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是(双选) ( )。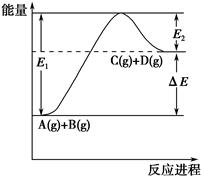
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,ΔE减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |