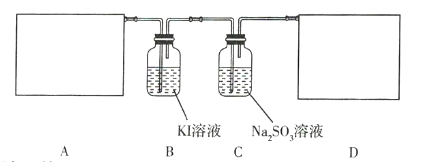
题目内容
【题目】如图①Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置,Ⅳ、Ⅴ、Ⅵ是气体收集装置。根据要求回答下列问题: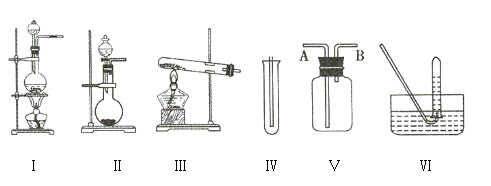
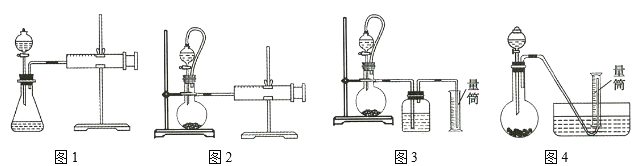
(1)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ 。
与浓盐酸反应制取氯气,应选用装置 ___________________ 。
(2)若用![]() 与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
与浓盐酸反应制取氯气,应选用装置 ___________________ ,试完成并配平下列离子方程式:
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________
+ ___________________ ![]() ___________________
___________________ ![]() + ___________________
+ ___________________ ![]() + ___________________ 。
+ ___________________ 。
(3)若选用装置Ⅳ为氯气的收集装置,则应该在试管口中放置一团棉花,该棉花团需用 ___________________ 溶液浸润,其作用是 ___________________ 。
(4)若选用装置Ⅴ为氯气的收集装置,则氯气应从 ___________________ (填“A”或“B”)口通入,利用化学原理检验氯气已收集满的方法是 ___________________ 。
【答案】Ⅰ II 2 10 16 2 5 ![]() 氢氧化钠 防止氯气逸出污染空气 A 将湿润的淀粉KI试纸放在B口处,若试纸变蓝色,则证明氯气已收集满
氢氧化钠 防止氯气逸出污染空气 A 将湿润的淀粉KI试纸放在B口处,若试纸变蓝色,则证明氯气已收集满
【解析】
(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;
(2)高锰酸钾与浓盐酸不需要加热即可制备氯气,所以选择装置II制备;反应中KMnO4+→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)氯气有毒,直接排放能够引起空气污染,氯气能够与碱反应,可以用氢氧化钠溶液吸收,所以若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用氢氧化钠溶液浸湿,其作用是吸收过量氯气,防止空气污染;
(4)氯气密度大于空气密度,应选择向上排气法收集,若选用Ⅴ为氯气收集装置,应长进短出,即从A口入;氯气具有氧化性能氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以将湿润的淀粉KI试纸放在B口处,若试纸变蓝色,则证明氯气已收集满。

【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀