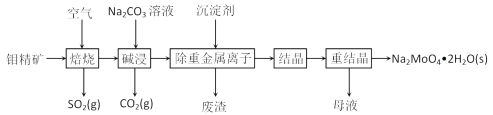
题目内容
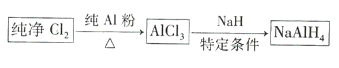
【题目】氢化铝钠![]() 是有机合成中的重要还原剂,其合成路线如图所示。
是有机合成中的重要还原剂,其合成路线如图所示。
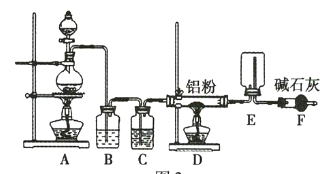
某实验小组利用如图所示的装置制备无水![]() 。
。
(1)装置F的作用是 _____________________________ 。
(2)![]() 与NaH反应时,需将
与NaH反应时,需将![]() 溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因可能是 _____________________________
(3)利用氢化铝钠遇水反应生成的氢气的体积测定氢化铝钠样品的纯度。
①其反应的化学方程式为 _____________________________
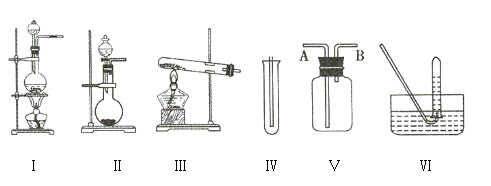
②设计如图四种装置测定氢化铝钠样品的纯度(假设杂质不参与反应)。
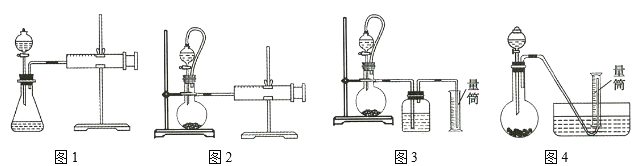
从简约性、准确性角度考虑,最适宜的装置是___________。
【答案】吸收未反应的![]() ,并防止空气中的水蒸气进入装置E NaH是离子化合物,难溶于有机溶剂,使反应物难以充分接触(或其他合理答案)
,并防止空气中的水蒸气进入装置E NaH是离子化合物,难溶于有机溶剂,使反应物难以充分接触(或其他合理答案) ![]() ②
②
【解析】
装置A中利用浓盐酸和二氧化锰固体共热制取氯气,B装置中盛放饱和食盐水除去氯气中的HCl气体,装置C对气体进行干燥,装置D中氯气与铝反应制取AlCl3,在装置E中凝华收集AlCl3,装置F对尾气进行处理,同时可以防止空气中的水蒸气进入装置E。
(1)该实验要制备无水AlCl3,需要整个装置中干燥,且氯气有毒未反应的氯气需要处理,所以装置F的作用为吸收未反应的Cl2,并防止空气中的水蒸气进入装置E;
(2)NaH是离子化合物,难溶于有机溶剂,使反应物难以充分接触,所以转化率较低;
(3)①氢化铝钠遇水反应生成的氢气,该过程为氢元素的归中氧化还原反应,其他元素的化合价不发生改变,所以方程式为![]() ;
;
②该实验通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,图1为封闭体系,装置内压强会升高,分液漏斗内液体无法顺利滴下;图3采用欲采用排水法收集,盛水的集气瓶长进短出无法实现排水收集;图4采用排水法收集气体,由于导管中会有气体残留以及液体的压力导致氢气体积的误差较大,且未采用恒压漏斗,液体可能会无法顺利滴下,综合考虑图2装置最适宜,采用恒压漏斗可使漏斗中液体顺利滴下,排空气法可避免导管中的残留气体。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案