题目内容
3.已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+$\frac{1}{2}$c(SO32-) | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| D. | 加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
分析 A.加入金属钠,先和水反应生成氢氧化钠和氢气,氢氧化钠抑制水解平衡①、促进电离平衡②;
B.依据溶液中电荷守恒分析判断;
C.加入氢氧化钠促进电离平衡右移,抑制水解平衡左移,最终导致亚硫酸根离子、氢氧根离子浓度都增大,氢离子、亚硫酸氢根离子浓度减小;
D.根据反应后的溶液中的物料守恒判断.
解答 解:A.加入少量金属Na,Na与HSO3-电离出的H+反应,促使平衡②右移,HSO3-离子浓度减小,又促使平衡①左移,平衡①左移,平衡②右移,溶液中c(HSO3-)浓度减小,故A错误;
B.加入少量Na2SO3固体溶解后溶液中存在电荷守恒,c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),故B错误;
C.加入氢氧化钠促进电离,平衡②右移,抑制水解,平衡①左移,最终溶液中c(SO32-),c(OH-)浓度增大,c(HSO3-)、c(H+)的浓度减小,则,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大.故C正确;
D.加入氨水至中性,c(H+)=c(OH-),根据物料守恒可得:c(Na+)=c(H2SO3)+c(SO32-)+c(HSO3-),所以c(Na+)>c(SO32-),故D错误;
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,试题涉及弱电解质的电离和盐类的水解、三大守恒关系的应用,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
13.下列各组中的两种粒子所含电子数相等的是( )
| A. | CH3+和NH4+ | B. | OH-和NH2- | C. | NO2和NO3- | D. | CH4和Na |
14.下列分子式只能表示一种物质的是( )
| A. | C4H9Cl | B. | C2H6O | C. | C2H5Cl | D. | C9H12 |
11.下列关于有机物的叙述正确的是( )
| A. | 煤经过分馏可得到焦炉气、煤焦油和焦炭 | |
| B. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、淀粉、油脂均能发生水解反应 |
8.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是( )
| A. | 电解水 | B. | 干冰受热直接变成气体 | ||
| C. | HCl溶解于水 | D. | 打雷放电时,O2变成O3 |
15.X和Y属于短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是( )
| A. | X可能是第二周期非金属元素 | B. | X可能是第三周期金属元素 | ||
| C. | Y可能与X同主族 | D. | Y可能是金属元素 |
11.有两种体积相同的某植物的营养液,其配方如下:对于两种营养液的成分,下列说法中,正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | |
| 2 | 0.1mol | 0.3mol | 0.1mol |
| A. | 只有K+的物质的量相等 | B. | 只有Cl-的物质的量相等 | ||
| C. | 完全相同 | D. | 各离子的物质的量完全不同 |
12.下列关于硫的说法正确的是( )
| A. | 硫的化学性质活泼,在自然界中只以化合态存在 | |
| B. | 硫是一种淡黄色能溶于水的固体 | |
| C. | 硫与金属或非金属反应均作氧化剂 | |
| D. | 1.6g硫与6.4g铜反应能得到8.0g纯净硫化物 |
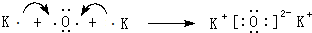 .
.