题目内容
15.X和Y属于短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是( )| A. | X可能是第二周期非金属元素 | B. | X可能是第三周期金属元素 | ||
| C. | Y可能与X同主族 | D. | Y可能是金属元素 |
分析 X和Y属于短周期元素,X原子的最外层电子数是次外层电子数的一半,则X为Li或P元素;Y位于X的前一周期,且最外层只有一个电子,则Y为H或Li元素,根据元素在周期表中的位置分析解答.
解答 解:X和Y属于短周期元素,X原子的最外层电子数是次外层电子数的一半,则X为Li或P元素;Y位于X的前一周期,且最外层只有一个电子,则Y为H或Li元素,
A.X可能为Li或P元素,如果位于第二周期,为金属元素,故A错误;
B.X可能是Li或P元素,P为第三周期非金属元素,故B错误;
C.如果X是Li元素、Y是H元素,二者位于同一主族,故C正确;
D.Y可能为H或Li元素,如果为Li元素,则为金属元素,故D正确;
故选CD.
点评 本题考查原子结构和元素性质,侧重考查学生发散思维能力,熟悉周期表结构、原子结构是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+$\frac{1}{2}$c(SO32-) | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| D. | 加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
10.用NA表示阿伏加德罗常数的值,下列有关物质结构中的说法正确的是( )
| A. | 78g Na2O2固体中所含阴阳离子个数均为2NA | |
| B. | 1.5g CH3+中含有的电子数为0.9NA | |
| C. | 3.4g氨气中含0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
6.用98%的浓硫酸配制10%的稀硫酸溶液100ml,应选用的仪器是( )
①量筒 ②酒精灯 ③玻璃棒 ④蒸发皿 ⑤烧杯 ⑥天平.
①量筒 ②酒精灯 ③玻璃棒 ④蒸发皿 ⑤烧杯 ⑥天平.
| A. | ①②③⑥ | B. | ①④⑤ | C. | ①②③④ | D. | ①③⑤ |
3.对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是( )
| A. | 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液 | |
| B. | 以铜为电极,电解1 mol/L硫酸溶液 | |
| C. | 以石墨为电极,电解含酚酞的饱和食盐水 | |
| D. | 以石墨为电极,电解1 mol/L溴化钾溶液 |
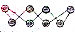 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.