题目内容
11.有两种体积相同的某植物的营养液,其配方如下:对于两种营养液的成分,下列说法中,正确的是( )| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | |
| 2 | 0.1mol | 0.3mol | 0.1mol |
| A. | 只有K+的物质的量相等 | B. | 只有Cl-的物质的量相等 | ||
| C. | 完全相同 | D. | 各离子的物质的量完全不同 |
分析 题中涉及物质都为强电解质,在溶液中完全电离,根据各电解质的物质的量计算离子的物质的量,确定离子关系,以此解答该题.
解答 解:①中n(K+)=0.3mol+0.2mol×2=0.7mol,n(SO42-)=0.2 mol+0.1mol=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.3 mol,
②中n(K+)=0.1mol+0.3mol×2=0.7mol,n(SO42- )=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.1mol+0.1mol×2=0.3 mol,
所以①和②中各种离子的物质的量:n(K+)=0.7 mol,n(SO42-)=0.3 mol,n (Zn2+)=0.1 mol,n(Cl-)=0.3 mol,所以成分相同,
故选C.
点评 本题综合考查物质的量,为高频考点,侧重学生的分析能力和计算能力的考查,注意物质的构成特点,难度不大.

练习册系列答案
相关题目
2.下列离子方程式正确的是( )
| A. | AlCl3溶液中滴加足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 铜片与浓HNO3:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O | |
| C. | NH4HCO3溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 一水合氨的电离:NH3•H2O=NH4++OH- |
3.已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+$\frac{1}{2}$c(SO32-) | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| D. | 加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
6.用98%的浓硫酸配制10%的稀硫酸溶液100ml,应选用的仪器是( )
①量筒 ②酒精灯 ③玻璃棒 ④蒸发皿 ⑤烧杯 ⑥天平.
①量筒 ②酒精灯 ③玻璃棒 ④蒸发皿 ⑤烧杯 ⑥天平.
| A. | ①②③⑥ | B. | ①④⑤ | C. | ①②③④ | D. | ①③⑤ |
3.对下列各溶液进行电解,通电一段时间后,溶液颜色不会发生显著改变的是( )
| A. | 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液 | |
| B. | 以铜为电极,电解1 mol/L硫酸溶液 | |
| C. | 以石墨为电极,电解含酚酞的饱和食盐水 | |
| D. | 以石墨为电极,电解1 mol/L溴化钾溶液 |
20.今有原子序数依次增大的A、B、C、D、E、F六种元素.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水.D和E各有如下表的电子层结构.在一般情况下,B元素不能与A、C、D、E元素的游离态化合而生成B的化合态.
按要求填空:
(1)各元素的元素符号分别为CAl,EP,D和E两者的氢化物稳定性较强的是PH3(填化学式).
(2)工业上制取单质D的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)A与C两元素的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)A和F形成的晶体中含有的化学键是离子键.
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| E | x+1 | x+4 |
(1)各元素的元素符号分别为CAl,EP,D和E两者的氢化物稳定性较强的是PH3(填化学式).
(2)工业上制取单质D的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)A与C两元素的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)A和F形成的晶体中含有的化学键是离子键.
1.下列有关说法正确的是( )
| A. | 水泥、玻璃、陶瓷等硅酸盐材料都不溶于水,所以所有的硅酸盐都不溶于水 | |
| B. | 水泥的主要成分有硅酸三钙(3CaO•SiO2)、硅酸二钙(2CaO•SiO2)及其他一些成分,所以硅酸盐都是氧化物 | |
| C. | 陶瓷分为土器、陶器、瓷器、炻器,与原料粘土的纯度有关 | |
| D. | 普通玻璃是透明的,所以硅酸盐也是透明的 |
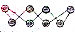 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.