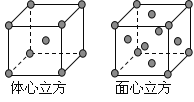
题目内容
【题目】(1)纯碱(![]() )、小苏打(
)、小苏打(![]() )广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程,小苏打发生分解反应,该反应的化学方程式是______;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的化学方程式是_______。
)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程,小苏打发生分解反应,该反应的化学方程式是______;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的化学方程式是_______。

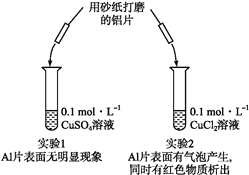
(2)某同学利用如图装置(夹持仪器已略去)研究纯碱和小苏打的性质。
①该实验的目的是_______。
②观察到有白色沉淀生成的烧杯是_________(填字母序号)。
③实验结论是__________。
④为进一步定量研究碳酸氢钠的性质,甲同学用天平准确称量![]() 碳酸氢钠,放入质量为
碳酸氢钠,放入质量为![]() 的坩埚中加热,冷却称量,理论上坩埚及剩余固体的总质量为______
的坩埚中加热,冷却称量,理论上坩埚及剩余固体的总质量为______![]() ,但实际称得的质量比该数值要大,可能的原因是________,改进的操作方法是_______________。
,但实际称得的质量比该数值要大,可能的原因是________,改进的操作方法是_______________。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 探究碳酸钠与碳酸氢钠的热稳定性 b 热稳定性碳酸钠大于碳酸氢钠 42.70 碳酸氢钠没有完全分解或冷却过程中吸收空气的水份 继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量
Na2CO3+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 探究碳酸钠与碳酸氢钠的热稳定性 b 热稳定性碳酸钠大于碳酸氢钠 42.70 碳酸氢钠没有完全分解或冷却过程中吸收空气的水份 继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量
【解析】
(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,与盐酸反应生成氯化钠、二氧化碳和水,据此书写;
(2)根据装置图可判断实验目的,结合碳酸钠和碳酸氢钠的性质差异、反应的方程式、可能产生的误差原因分析解答。
(1)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
Na2CO3+H2O+CO2↑;碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)①根据装置图可知该实验的目的是探究碳酸钠与碳酸氢钠的热稳定性。
②由于碳酸氢钠受热易分解生成二氧化碳、水和碳酸钠,则观察到有白色沉淀生成的烧杯是b。
③根据实验现象可知其实验结论是:热稳定性碳酸钠大于碳酸氢钠。
④8.4g碳酸氢钠的物质的量是8.4g÷84g/mol=0.1mol,根据方程式2NaHCO3![]() Na2CO3+H2O+CO2↑可知固体减少的质量是0.05mol×(18+44)g/mol=3.1g,则理论上坩埚及剩余固体的总质量为8.4g-3.1g+37.40g=42.70g;若实际称得的质量比该数值要大,可能的原因是碳酸氢钠没有完全分解或冷却过程中吸收空气的水份,因此改进的操作方法是继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量。
Na2CO3+H2O+CO2↑可知固体减少的质量是0.05mol×(18+44)g/mol=3.1g,则理论上坩埚及剩余固体的总质量为8.4g-3.1g+37.40g=42.70g;若实际称得的质量比该数值要大,可能的原因是碳酸氢钠没有完全分解或冷却过程中吸收空气的水份,因此改进的操作方法是继续加热,在干燥器中冷却后称量,直到质量不再变化为止或放置在干燥器中冷却后称量。

【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法不正确的是
2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法不正确的是
实验序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
I | 600℃ | 1mol | 3mol | 96kJ |
II | 800℃ | 1.5mol | 0.5mol | —— |
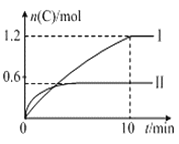
A. 实验Ⅰ中,10 min内平均速率v(B)=0.03 mol·L-1·min-1
B. 上述方程式中a=160
C. 600 ℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大